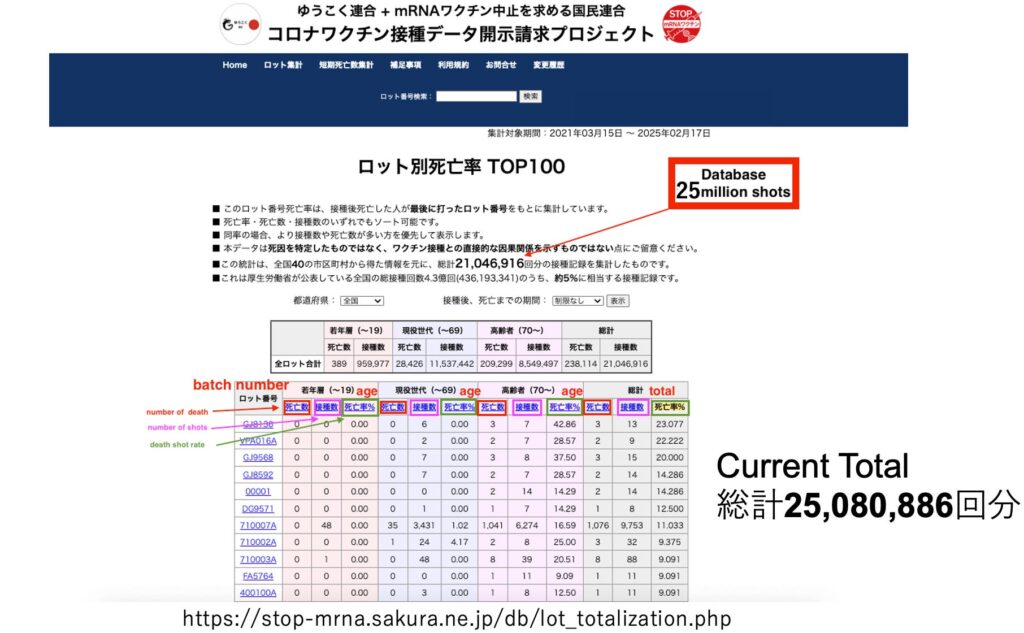
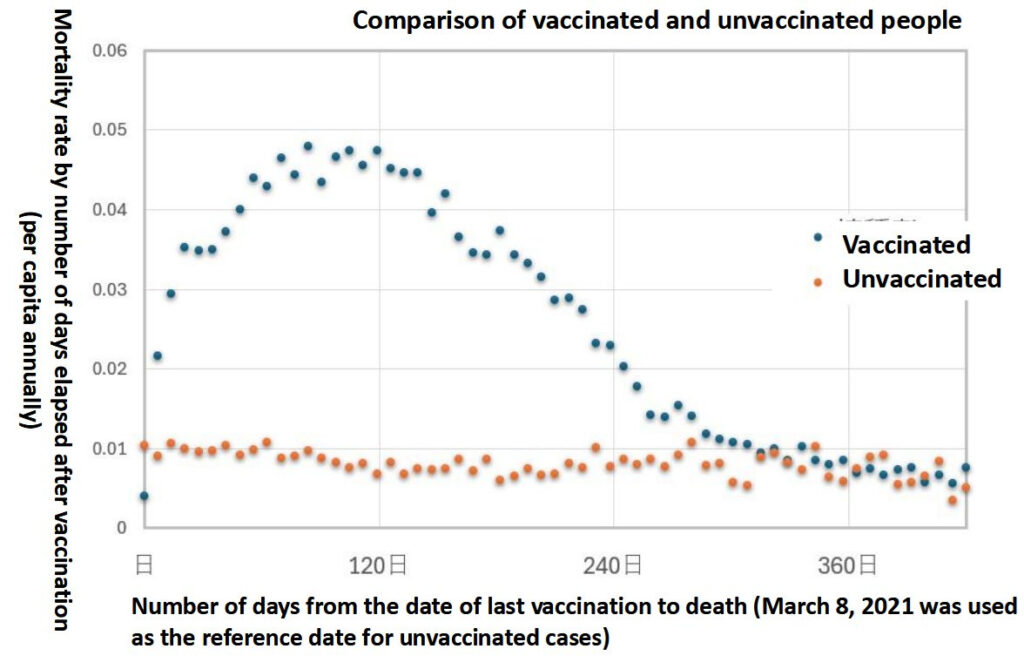
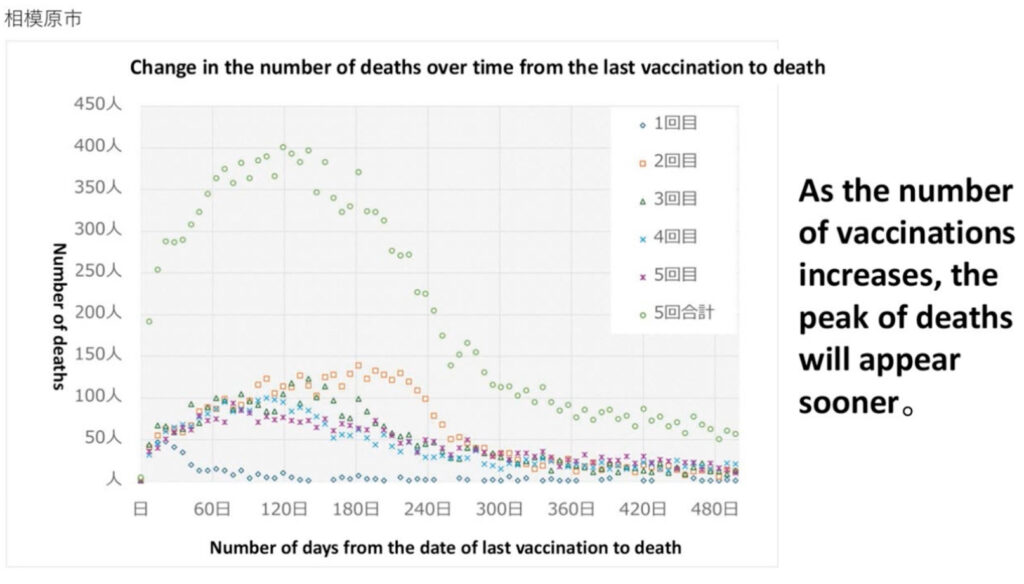
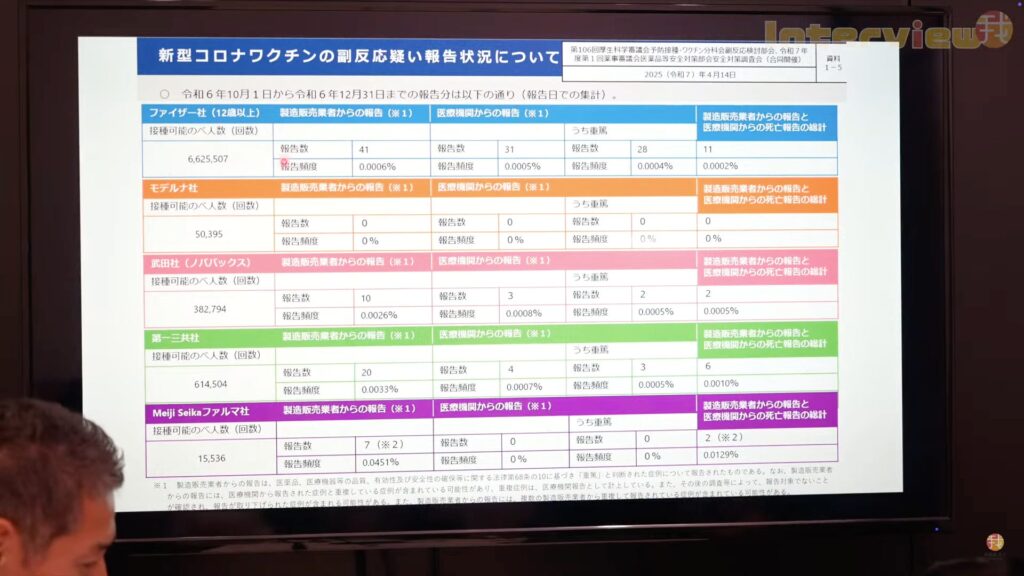
Source : Epoch Times
Par Etienne Fauchaire
DECRYPTAGE – Face à la santé financière dégradée des comptes de la Sécurité sociale, le gouvernement entend faire passer le vaccin contre la grippe comme un outil de redressement budgétaire. Soignants, retraités, salariés : tous pourraient bientôt voir cette vaccination passer du statut de recommandation à celui d’obligation, déclarée ou déguisée. Présentée comme un geste de prévention et un moyen de freiner la transmission, le vaccin anti-grippe, cependant, faillit à sa mission. Car derrière les messages politiques, de nombreux experts s’accordent sur l’état actuel des connaissances scientifiques : il n’existe aucune preuve solide de son efficacité. Au contraire. Le Dr Robert Malone, biologiste moléculaire et expert au sein du comité consultatif sur les pratiques vaccinales des CDC aux États-Unis, indique à Epoch Times que la vaccination annuelle serait même « contre-productive ». Une politique sanitaire qui, loin de soulager les finances publiques, pourrait donc bien les grever davantage.
L’atmosphère rappelle les heures tendues de la période Covid. Alors que le gouvernement cherche à colmater le déficit de la Sécurité sociale, l’idée d’une vaccination obligatoire contre la grippe, jusqu’ici simplement recommandée, refait surface.
Le débat, cela étant, ne date pas d’hier. En 2005, sous la présidence de Jacques Chirac, le ministre de la Santé Xavier Bertrand avait déjà fait adopter une loi rendant le vaccin antigrippal obligatoire pour les soignants, promulguée par Dominique de Villepin. Moins d’un an plus tard cependant, un décret suspendait cette obligation, après qu’un avis du Conseil supérieur d’hygiène publique de France estimait notamment qu’elle « risquerait d’altérer l’adhésion » du personnel médical. Depuis, la vaccination reste facultative, mais la question revient régulièrement sur la table.
Une offensive estivale
Sans surprise, les soignants se retrouvent une fois encore en première ligne. Le 11 juillet, Agnès Firmin Le Bodo, ancienne ministre de la Santé et députée Horizons, condamnée en 2024 par le tribunal correctionnel du Havre pour avoir accepté des cadeaux non déclarés des laboratoires Urgo alors qu’elle exerçait comme pharmacienne, a déposé une proposition de loi visant à rétablir l’obligation vaccinale dans le milieu médical.
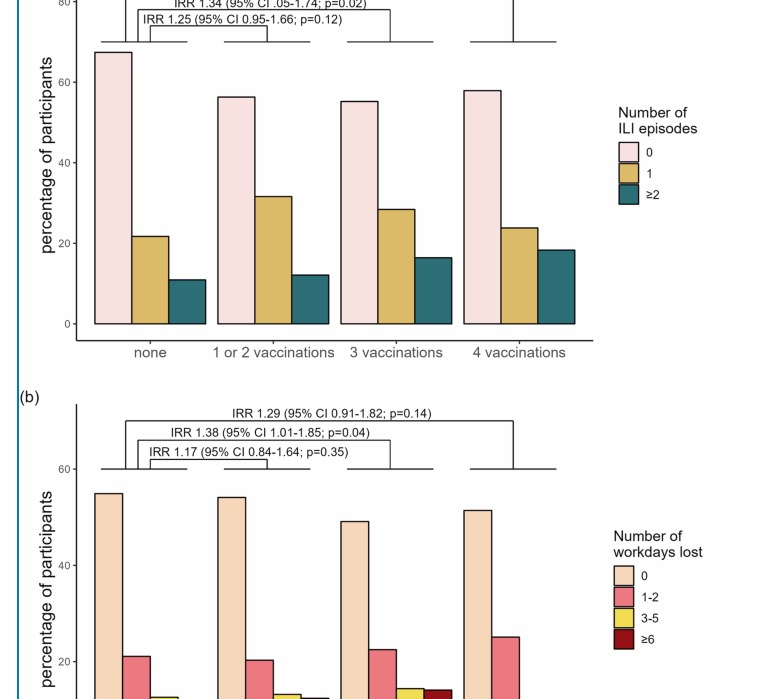
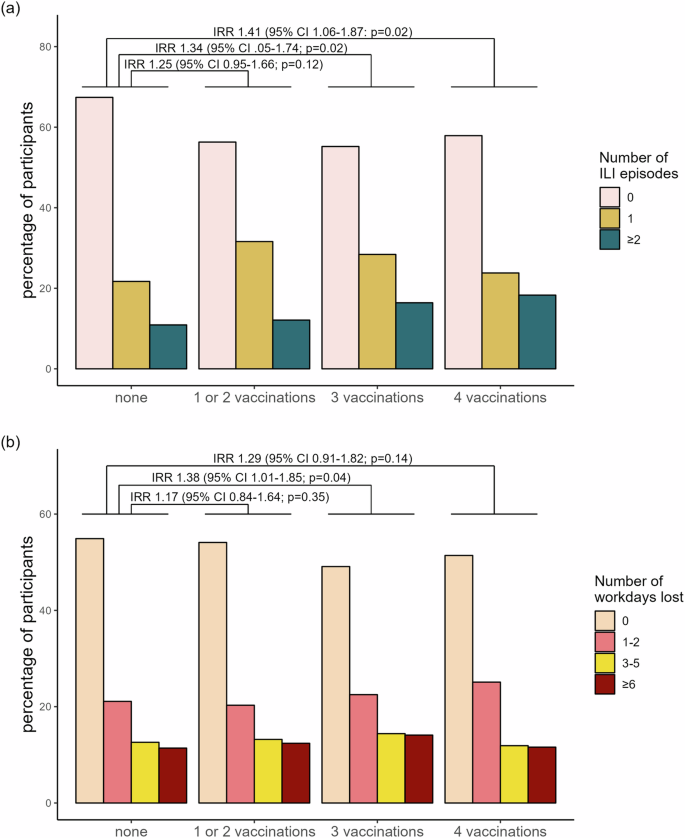
Selon l’exposé des motifs, la mesure permettrait de « réduire significativement le risque de transmission du virus de la grippe » aux « patients vulnérables ». Le texte pointe également une couverture vaccinale des soignants jugée insuffisante. Et pour cause : depuis longtemps, la vaccination antigrippale est largement impopulaire à l’hôpital. Sur les saisons 2022-2023 et 2023-2024, seuls 19% d’entre eux y ont consenti à l’échelle nationale, selon la Haute Autorité de santé. Au sein des établissements médico-sociaux, la couverture n’a pas dépassé 22% pour la saison 2024-2025, d’après Santé Publique France, qui constate de manière générale « une forte réticence à la vaccination » de la part des professionnels.
Les personnes âgées, considérées comme les plus exposées au risque d’hospitalisation ou de décès, sont également dans le collimateur de l’exécutif. Dans un entretien au Monde publié le 26 juillet, la ministre de la Santé Catherine Vautrin a déclaré souhaiter que « la vaccination devienne obligatoire pour les personnes âgées en établissement ».
Le secteur privé ne devrait pas non plus être épargné. Le 9 juillet, dans une série de recommandations destinées à réduire les dépenses de santé, le Medef a proposé de « généraliser la vaccination en entreprise, notamment contre la grippe », et de conditionner, partiellement ou totalement, le remboursement des arrêts maladie à la preuve de vaccination.
L’organisation patronale défend cette mesure en arguant qu’elle « permet de mieux protéger les salariés à risque et leur entourage », tout en garantissant la continuité de l’activité économique, avec, selon ses calculs, une division du taux d’absentéisme par 2,4. En contrepartie, elle réclame un remboursement intégral du vaccin par la Sécurité sociale, actuellement réservé aux populations dites « à risque » : plus de 65 ans, femmes enceintes, soignants, personnes obèses.
Cette orientation, François Bayrou pourrait la retenir. Lors de sa conférence de presse de mi-juillet sur son plan budgétaire d’économies, le Premier ministre a insisté sur la nécessité de « responsabiliser » les Français « par la prévention, notamment la vaccination », faisant valoir que « trois quarts des personnes en réanimation lors des épidémies de grippe ne sont pas vaccinées ».
Mais le rétablissement d’une obligation vaccinale pourrait rallumer des tensions, notamment dans les hôpitaux, où elles sont déjà vives. Tout récemment, Catherine Vautrin et Yannick Neuder ont fait l’objet de 19 plaintes déposées devant la Cour de justice de la République sur des accusations de « harcèlement moral » et de « mise en péril de la personne », après une série de suicides survenus dans des établissements hospitaliers aux conditions de travail qualifiées de « totalement illégales et mortifères ». Elles ont toutes été classées, principalement pour « irrégularité de forme ». À la surprise de l’avocate des plaignants, Me Christelle Mazza, qui a dénoncé une juridiction dépourvue des moyens juridiques et politiques « de remplir son office ».
L’État consacrant chaque année en outre, avec l’argent des contribuables, plusieurs dizaines de millions d’euros à l’achat de vaccins antigrippaux, la question de leur réelle efficacité dans la lutte contre ce virus se pose dès lors avec d’autant plus d’acuité.
Ce que dit la science
À rebours des affirmations du Premier ministre François Bayrou, du Medef ou encore de l’ancienne ministre de la Santé Agnès Firmin Le Bodo, la vaccination n’a en réalité « aucun effet » démontré sur les hospitalisations, et il n’existe « aucune preuve que les vaccins empêchent la transmission du virus ou les complications » liées à la maladie. C’est la conclusion sans appel qui ressort d’une méta-analyse approfondie publiée en 2010 par la prestigieuse collaboration Cochrane, référence internationale en matière de revues systématiques de la littérature médicale, sur l’efficacité des injections contre la grippe.
Les conclusions allaient même plus loin. Les chercheurs estimaient que les données disponibles « semblent décourager le recours à la vaccination contre la grippe chez les adultes en bonne santé comme mesure de santé publique de base ». Ils accusaient par ailleurs les Centres pour le contrôle et la prévention des maladies (CDC) américains, partisans d’une vaccination universelle, de déformer volontairement la littérature scientifique afin de justifier leurs recommandations.
Cette méta-analyse abordait également la question des effets indésirables, évoquant notamment le risque rare de développer un syndrome de Guillain-Barré, une maladie neurologique grave entraînant une paralysie progressive. Le risque était estimé entre 1 et 2 cas par million de doses injectées, selon une étude citée, bien que jugée entachée « de nombreuses limitations ». Quoi qu’il en soit, les auteurs concluaient que « cette littérature démontre le danger de lancer une campagne de vaccination de grande ampleur sans évaluation adéquate des risques ».
En 2014, Cochrane publiait une nouvelle méta-analyse, élargie à un corpus d’études plus récentes et plus nombreuses. Le constat restait inchangé : les données disponibles « n’apportent aucune preuve en faveur de l’utilisation de la vaccination contre la grippe chez les adultes en bonne santé comme mesure de santé publique de base ».
En France, s’agissant du personnel médical, plusieurs institutions se sont prononcées en faveur d’un retour à l’obligation vaccinale contre la grippe : l’Académie nationale de médecine en 2020 et 2023, la Cour des comptes dans un rapport de 2018, ou encore la Fédération hospitalière de France en mai 2025. Cependant, la Haute Autorité de santé (HAS) demeure, elle, plus réservée.
Dans un avis rendu en juillet 2023, la HAS, si elle note que plusieurs études suggèrent « qu’une meilleure couverture vaccinale des soignants pourrait réduire significativement le nombre d’infections et de décès chez les patients hospitalisés », constate dans le même temps que ces travaux n’apportent, à ce jour, « qu’un faible niveau de preuves ».
Ainsi, si l’autorité sanitaire estime que « la faible couverture pose légitimement la question de l’obligation vaccinale », elle préfère s’en tenir pour l’instant à une recommandation, mettant en avant « l’insuffisance des données disponibles à ce jour sur le fardeau de la grippe nosocomiale [grippe contractée à l’hôpital, ndlr] » et sur « l’impact de la vaccination des soignants sur ce fardeau ». Toutefois, elle rappelle que ses avis « sont susceptibles d’évoluer selon l’évolution des données et du contexte sanitaire ».
Interrogés par Epoch Times, des experts confirment que l’instauration d’une obligation vaccinale contre la grippe s’appuierait donc bien davantage sur des motivation politiques que sur la littérature scientifique.
« Une vaccination universelle contre la grippe, ou même ciblée sur les professionnels de santé, permettrait-elle de supprimer le risque de transmission à l’hôpital ? La réponse est non », martèle le Dr Robert Malone.
Aujourd’hui membre du comité consultatif sur les pratiques vaccinales rattaché aux CDC, le pionnier de la technologie à ARN messager rappelle que « la capacité des vaccins antigrippaux à réduire de manière significative le risque d’infection et de réplication du virus est très faible ». Il ajoutait que ces vaccins « peuvent bel et bien provoquer des effets indésirables, même s’ils sont généralement moins graves ou moins fréquents que ceux associés aux vaccins à ARNm ou à vecteur adénoviral contre le Covid ».
Des effets indésirables sous-évalués ?
Outre-Atlantique, au 1er juin 2025, 10.988 plaintes avaient été déposées auprès du Vaccine Injury Compensation Program (VICP), le programme fédéral américain d’indemnisation des victimes de vaccins, pour des effets indésirables graves ou des décès survenus après une vaccination contre la grippe. Parmi elles : 261 décès et 10.727 cas d’effets secondaires graves. La Cour des réclamations des États-Unis, qui instruit ces dossiers, a accordé une indemnisation à 7 291 personnes, adultes comme enfants.
Toutefois, ces chiffres pourraient être largement sous-estimés. Une étude financée en 2010 par le ministère américain de la Santé estimait que moins de 1 % des effets indésirables liés aux vaccins seraient effectivement déclarés. Le nombre réel d’effets graves associés à la vaccination contre la grippe pourrait donc être bien plus élevé, avertit l’organisation Children’s Health Defense fondée par Robert Kennedy Jr, qui milite pour une transparence accrue sur les risques vaccinaux.
Selon les données officielles, ces effets graves existent donc bien, mais restent néanmoins rares au regard des dizaines de millions de doses administrées chaque année aux États-Unis. Ils incluent, en plus du syndrome de Guillain-Barré, des cas de myocardite, d’accidents vasculaires cérébraux, de névrite optique ou encore de paralysie faciale (paralysie de Bell).
En France, l’indemnisation de ces effets graves est impossible. L’Office national d’indemnisation des accidents médicaux (Oniam) — organisme public chargé de traiter à l’amiable les préjudices médicaux et dont Epoch Times a documenté les dysfonctionnements récurrents — n’indemnise pas les dommages causés par les vaccins contre la grippe saisonnière.
Contacté, le Dr Jean-Marc Sabatier, directeur de recherche au CNRS, docteur en biologie cellulaire et microbiologie, habilité à diriger des recherches en biochimie, estime également que le rapport bénéfice-risque est défavorable. « L’efficacité des vaccins contre la grippe sur la transmission du virus est quasi nulle », rappelle-t-il lui aussi à Epoch Times.
À ce titre, il s’indigne de l’avis de la Haute Autorité de santé rendu en février 2023, qui recommande que la vaccination antigrippale soit étendue chaque année aux enfants de 2 à 17 ans sans comorbidité, dans le but affiché de « limiter la diffusion du virus » dans la population.
Une étude parue le 18 janvier 2018 dans la revue scientifique de référence Proceedings of the National Academy of Sciences (PNAS) observait pourtant que les personnes vaccinées contre la grippe exhalaient même en moyenne plus de six fois plus de particules virales sous forme d’aérosols que les non-vaccinés. Les auteurs concluaient que, si cette observation venait à être confirmée, elle pourrait remettre en question les politiques vaccinales en vigueur.
Une efficacité titubante
Alertant également sur les effets indésirables potentiels de l’injection, le Dr Jean-Marc Sabatier estime qu’il n’existe guère non plus de justification scientifique à se faire vacciner uniquement dans un but de protection individuelle. L’efficacité des vaccins antigrippaux contre l’infection symptomatique, souligne-t-il auprès d’Epoch Times, « n’est pas formidable, et varie fortement d’une saison à l’autre ».
En France, pour la saison 2024-2025, le réseau RELAB, qui surveille les virus respiratoires et collabore avec Santé publique France, a publié dans Eurosurveillance une estimation de 22 % d’efficacité du vaccin chez les personnes âgées de 65 ans et plus.
Indépendamment de leur impact sur la transmission, l’efficacité même des vaccins contre l’infection grippale fait l’objet de critiques récurrentes. En 2017, l’influente revue Science, dans un article intitulé « Pourquoi les vaccins anti-grippe échouent si souvent… », écrivait : « Ce qu’on ne dit pas, c’est à quel point ce vaccin est peu performant. Les vaccins les plus couramment utilisés ne protègent pas plus de 60 % des personnes vaccinées ; certaines années, leur efficacité chute jusqu’à 10 %. »
En cause : un processus de fabrication soumis à de fortes incertitudes. « Ce qu’il faut savoir, c’est que les vaccins contre la grippe sont conçus six mois avant le début de la saison hivernale, à partir des souches virales identifiées dans l’hémisphère Sud », explique le Dr Sabatier. « Entre le mois de février, où ces choix sont arrêtés, et l’automne suivant, le virus a largement le temps de muter. Résultat : les souches retenues ne correspondent pas toujours à celles qui circulent réellement quelques mois plus tard dans l’hémisphère Nord. »
Mais le problème ne se limite pas seulement à un décalage viral, rapportait Science : des scientifiques ont constaté « que l’efficacité du vaccin peut s’avérer chancelante même lorsque les bonnes souches ont été utilisées pour le fabriquer ». Autrement dit, le vaccin peut être peu protecteur même dans les meilleures conditions théoriques.
Interrogée par la revue, Danuta Skowronski, épidémiologiste au Centre de contrôle des maladies de la Colombie-Britannique (Canada), reconnaissait que le programme de vaccination s’appuyait sur « des hypothèses empilées les unes sur les autres », et confiait que nombre de chercheurs spécialisés dans l’étude du virus hésitent à évoquer publiquement les limites du vaccin, de peur du qu’en dira-t-on.
Vaccination annuelle
Selon le Dr Robert Malone, l’un des problèmes fondamentaux liés à la vaccination annuelle contre la grippe réside dans le « péché originel antigénique », aussi appelé empreinte immunitaire. « Ces injections répétées peuvent induire une forme de tolérance immunitaire, ou un biais de réponse favorisant la souche contre laquelle vous avez été vacciné, ce qui affectera la capacité de votre système immunitaire à lutter contre de nouveaux variants », explique-t-il à Epoch Times.
Plusieurs études confirment que la vaccination répétée contre la grippe peut se révéler, par certains aspects, « contre-productive ». Une recherche financée par les CDC américains et publiée en septembre 2014 dans la revue Clinical Infectious Diseases a examiné l’impact de la vaccination répétée sur cinq saisons consécutives. Les résultats : plus une personne avait été vaccinée dans les années précédentes, moins le vaccin était efficace contre le virus H3N2, souche dominante cette année-là.
Les auteurs résumaient ainsi leurs conclusions : « La protection vaccinale était la plus élevée chez les personnes non vaccinées durant les cinq années précédentes. » Ils appelaient à de nouvelles recherches, notant que ces résultats « soulèvent d’importantes questions sur l’interférence potentielle liée à la vaccination annuelle répétée », ainsi que sur « une éventuelle protection résiduelle conférée par les vaccins antérieurs ».
Une autre étude marquante, publiée en 2020 dans Eurosurveillance, a approfondi cette problématique. Elle portait sur des personnes âgées de 65 ans et plus ayant contracté une grippe confirmée en laboratoire, et évaluait l’efficacité du vaccin pour la saison en cours en fonction du nombre de vaccinations antérieures sur une période de dix ans : une première à cette échelle.
Chez les personnes vaccinées uniquement pour la saison 2015-2016, sans antécédents de vaccination au cours de la décennie précédente, l’efficacité du vaccin se révélait modeste : 34 %. Mais cette efficacité chutait progressivement avec l’augmentation du nombre de vaccinations cumulées : 26 % chez celles ayant reçu 1 à 3 doses dans les dix dernières années, 24 % pour 4 à 6 doses, 13 % pour 7 à 8, et à peine 7 % pour celles vaccinées 9 à 10 fois.
Une efficacité vaccinale négative ?
La vaccination contre la grippe pourrait-elle aussi, parfois, produire l’effet inverse de celui recherché ? La question a surgi sur la toile en avril 2025, à la suite de la publication d’une étude menée par la Cleveland Clinic (États-Unis), portant sur 53.402 employés de cet hôpital universitaire. Non encore revue par les pairs, l’étude révèle que les personnes vaccinées contre la grippe pour la saison 2024-2025 présentaient un risque accru de 27 % de contracter le virus par rapport aux non-vaccinés. « La vaccination contre la grippe était associée à un risque accru de grippe chez les adultes travaillant dans le secteur de la santé », peut-on lire.
Cependant, les auteurs n’avancent pas que le vaccin en est la cause directe et ne remettent pas non plus en question l’utilité de la vaccination, relativisant plutôt ses performances : « Compte tenu de toutes les variables qui peuvent influencer l’efficacité du vaccin d’une année sur l’autre, et des procédés actuels de fabrication, il est peut-être illusoire d’en attendre une efficacité élevée chaque année », temporisent-ils.
Néanmoins, en France, les résultats de cette étude d’envergure pourraient conforter la Haute Autorité de santé dans la position qu’elle avait exprimée dans son avis rendu en juillet 2023 : une recommandation de vaccination pour les soignants, plutôt qu’une obligation en raison, invoquait-elle, de « l’efficacité inconstante, selon les années, de la vaccination antigrippale » et du « faible niveau de preuve des études » quant à son impact sur le fardeau de la grippe nosocomiale.
Par ailleurs, l’étude de la Cleveland Clinic n’est pas la première à mettre en lumière une augmentation du risque d’infections respiratoires, grippales ou non, chez les personnes vaccinées contre la grippe.
Pour rappel, une distinction essentielle entre grippe et syndrome grippal : la grippe est une infection respiratoire aiguë causée par un virus Influenza, tandis qu’un syndrome grippal peut être aussi provoqué par d’autres virus, comme les coronavirus, le virus respiratoire syncytial (VRS) ou encore des rhinovirus.
En avril 2010, une étude publiée dans PLoS Medicine révélait les résultats « inattendus » issus de quatre études épidémiologiques au Canada : les personnes ayant reçu le vaccin contre la grippe saisonnière 2008-2009 étaient davantage susceptibles de contracter le virus pandémique A(H1N1), dit « grippe porcine », apparu au printemps 2009. Bien que le vaccin ait semblé efficace contre la souche initiale, il était paradoxalement associé à une augmentation du risque de contracter le virus émergent. Selon les auteurs, cette situation pourrait s’expliquer par une réponse immunitaire moins robuste que celle induite par une infection naturelle.
D’après leur hypothèse, la vaccination répétée « empêche de développer une immunité plus robuste, complexe et étendue, comme celle que confère une infection antérieure ». Cette immunité croisée conférerait une protection non seulement contre la souche en circulation, mais aussi contre ses variants. En d’autres termes, les personnes vaccinées chaque année auraient manqué l’occasion de développer cette immunité élargie, soulignaient les auteurs.
Des résultats similaires ont été observés dans une étude menée par les National Institutes of Health (NIH) et publiée en 2005 dans Archives of Internal Medicine (aujourd’hui JAMA Internal Medicine). Les chercheurs ont constaté que les personnes âgées exposées au virus H3N2 lors de la pandémie de 1968 bénéficiaient d’une protection immunitaire à long terme, nettement supérieure à celle conférée par la vaccination. La diminution notable de la mortalité grippale chez les 65-74 ans dans les années suivant cette pandémie était, selon eux, « très probablement due à l’immunité naturelle acquise ».
Plus récemment, plusieurs études ont signalé un risque accru d’infections respiratoires non grippales chez les personnes vaccinées. En 2020, une étude menée au sein du Département de la défense des États-Unis et publiée dans la revue Vaccine a rapporté une hausse de 36 % du risque d’infection par un coronavirus chez les vaccinés contre la grippe, comparés aux non-vaccinés.
Une autre étude publiée en 2012 dans Clinical Infectious Diseases a observé « un risque accru statistiquement significatif d’infections causées par des virus respiratoires non grippaux » chez les personnes ayant reçu un vaccin antigrippal inactivé. Les auteurs ont formulé une hypothèse inquiétante : le vaccin pourrait, « par un mécanisme biologique encore inconnu », renforcer la protection contre la grippe au détriment de la défense immunitaire face à d’autres virus respiratoires.
Enfin, une étude financée par les CDC et publiée en 2018 dans Vaccine a mis en évidence une augmentation des infections respiratoires aiguës non grippales chez les enfants vaccinés contre la grippe, comparés aux enfants non vaccinés. D’autres travaux sont venus corroborer ces observations.
Une mortalité grippale surestimée
Chaque année, les autorités sanitaires françaises lancent des appels à la vaccination contre la grippe, largement relayés par la presse. Ces campagnes s’accompagnent souvent de chiffres marquants, notamment du nombre de décès attribués à l’épidémie. Selon Santé publique France, la grippe serait responsable, en moyenne, d’environ 9000 morts par saison entre 2011-2012 et 2021-2022. Les personnes âgées de plus de 65 ans sont considérées comme les plus vulnérables, tant en termes d’hospitalisations que de mortalité.
Mais, en réalité, le nombre exact de morts causées par la grippe est très difficile à établir. Cette incertitude était déjà soulignée par la commission d’enquête du Sénat dans son rapport de 2010 sur la gestion gouvernementale de la pandémie de grippe A(H1N1) et le rôle des laboratoires pharmaceutiques.
Le document notait que la virulence réelle du virus saisonnier « n’est pas connue avec précision ». Les chiffres de mortalité avancés pour ce virus ne reposent pas sur un décompte individuel, mais « sur une simple mesure de la surmortalité hivernale », rappelait-elle. Autrement dit, les décès survenus en hiver sans cause clairement identifiée sont, globalement, attribués à la grippe, parce que celle-ci circule à ce moment-là.
Concernant la pandémie de H1N1, le rapport, critique des « propos alarmistes » de certains experts, rappelait que l’Institut de veille sanitaire (InVS) prévoyait dans un avis du 28 septembre 2009 entre 6400 et 96.000 morts, soit « 2 à 30 fois plus que la grippe saisonnière ». En mai 2009, Antoine Flahault, directeur de l’École des hautes études en santé publique (EHESP), évoquait lui 30.000 décès possibles. La réalité fut toute autre : la France a comptabilisé 312 décès dus au H1N1. La commission d’enquête du Sénat allait jusqu’à s’interroger sur le fait que certaines prévisions scientifiques ne soient pas « devenues, inconsciemment, des espérances ».
Le Dr Dominique Dupagne, médecin généraliste et ancien chroniqueur santé sur France Inter, notait sur son site que même ce chiffre de 312 décès devait être considéré avec précaution : « Nous n’avons même pas la preuve de la responsabilité de la grippe pour de nombreux morts. Tout décès d’un sujet jeune présentant une maladie ressemblant à la grippe a été comptabilisé. » Il saluait néanmoins, dans ce cas particulier, le fait qu’un véritable décompte ait été réalisé.
Lors de son audition devant la commission du Sénat en mai 2010, le Dr Dupagne avait expliqué, avec ironie, que l’estimation annuelle des décès dus à la grippe saisonnière relevait davantage de « la lecture du marc de café ou des entrailles de poulet » que d’un décompte rigoureux. Il affirmait se baser sur des données épidémiologiques plus plausibles, notamment une étude menée dans les 80 départements français les plus peuplés, selon laquelle le nombre réel de morts annuels serait d’environ 500. Des décès survenus majoritairement chez des personnes en fin de vie, dont, disait-il, « le dernier souffle est légèrement avancé par la grippe ».
Le médecin exprimait alors un constat sévère : lui et ses confrères avaient « perdu confiance » dans les chiffres communiqués par les autorités sanitaires, estimant que ces dernières étaient capables de « multiplier les estimations par dix, cent, voire mille, et le tout sans un accroc dans la voix ».
En cela, il rejoint l’analyse du Dr Peter Doshi, rédacteur en chef adjoint du British Medical Journal (BMJ) qui dès 2005, dans un article intitulé « Disséquer la tromperie du CDC : les chiffres des décès dus à la grippe aux États-Unis relèvent-ils plus du marketing que de la science ? », accusait les CDC de gonfler délibérément, eux aussi, leurs estimations en fusionnant les décès dus à la grippe avec ceux causés par des pneumonies.
Pour appuyer sa démonstration, Doshi rappelait qu’en 2001, les CDC avaient annoncé 62.034 décès liés à la grippe et à la pneumonie. Pourtant, selon les données du National Center for Health Statistics (NCHS), seuls 257 cas pouvaient être attribués à la grippe, dont à peine 18 cas confirmés en laboratoire, soit 0,03 % du total. La quasi-totalité de ces décès n’étaient donc pas dus à la grippe, et ne pouvaient donc être évités par la vaccination.
Selon les mêmes sources, si l’on isole uniquement les décès liés à la grippe, la moyenne annuelle entre 1979 et 2002 s’élèverait à environ 1348 morts par an aux États-Unis, un chiffre très éloigné des dizaines de milliers souvent avancés. Aussi, pour Peter Doshi, ces écarts ne sont pas innocents. Il accusait ouvertement les CDC de manipuler les chiffres à des fins promotionnelles, pour soutenir les intérêts des fabricants de vaccins et augmenter la couverture vaccinale antigrippale.
Conflits d’intérêts avec l’industrie pharmaceutique
Ce soupçon d’instrumentalisation des morts de la grippe est partagé en France. Lors de son audition devant la commission d’enquête du Sénat en mai 2010, le Dr Dominique Dupagne pointait le chiffre d’affaires « considérable » généré par la vaccination saisonnière et s’étonnait qu’aucune exigence de preuve n’ait été formulée à l’égard des laboratoires : « Pourquoi les autorités sanitaires n’ont-elles pas exigé des laboratoires des études épidémiologiques solides ? »
Et de conclure avec provocation : « Est-ce vraiment une politique de santé publique utile de vacciner toute la population chaque année, y compris les personnes non à risque, pour une maladie dont le taux de mortalité se situe autour de 1 pour 100.000 ? Il y a des priorités plus urgentes pour nos budgets sociaux. Malheureusement, il y a des choses inévitables : des gens meurent de la varicelle tous les ans, d’autres en allant à la pharmacie se font écraser par une voiture. Chercher le risque zéro est absurde ».
Interrogé sur la réflexion de Yannick Neuder, qui évoquait en janvier dernier la possibilité de rendre la vaccination anti-grippale obligatoire pour les soignants, le sociologue Laurent Mucchielli, directeur de recherche au CNRS, disait y voir dans un entretien à Epoch Times l’expression « d’une idéologie de la vaccination universelle et obligatoire promue par tous les moyens et portée par l’industrie pharmaceutique ». Selon le chercheur, « cette idéologie s’est imposée chez une partie des élites politiques, parfois au prix de véritables pactes de corruption ».
Pour Children’s Health Defense, l’injection contre la grippe est avant tout « une affaire de gros sous ». En 2024, le marché américain pour ce produit était estimé à 4,78 milliards de dollars et pourrait atteindre près de 10 milliards de dollars d’ici 2033, selon Research and Markets.
La Commission d’enquête du Sénat sur la gestion de la grippe H1N1 faisait déjà référence à ce type de dérive dans son rapport de 2010, citant la résolution de l’Assemblée parlementaire du Conseil de l’Europe : « Faute de procédures transparentes de contrôle des conflits d’intérêts, l’APCE observe que le débat reste ouvert sur la possibilité d’une influence des laboratoires pharmaceutiques : “L’éventualité que les représentants de l’industrie aient pu directement peser sur les décisions publiques et les recommandations émises au sujet de la grippe H1N1 reste l’une des questions centrales du débat actuel.” »
« Aucune preuve de l’efficacité vaccinale sur la mortalité des personnes âgées »
Des chercheurs issus d’institutions prestigieuses ont aussi remis en question l’efficacité de la vaccination antigrippale pour réduire la mortalité même des personnes âgées.
L’étude des National Institutes of Health (NIH) publiée en 2005 dans Archives of Internal Medicine soulignait que malgré l’augmentation massive de la couverture vaccinale chez les plus de 65 ans, passée de 20 % avant 1980 à 65 % en 2001, les taux de mortalité liés à la grippe et à la pneumonie avaient « augmenté de manière significative pendant cette période ».
Dans un article coécrit en 2006, le Dr Lone Simonsen, auteure principale de l’étude, et le Dr William Glezen affirmaient dans l’International Journal of Epidemiology qu’aucune preuve ne montrait que cette hausse de la vaccination chez les seniors avait permis de réduire les hospitalisations ou les décès : au contraire, « la mortalité et les hospitalisations ont continué à augmenter. »
Les auteurs qualifiaient ces résultats de « surprenants », dans la mesure où la vaccination est censée être « très efficace pour réduire la mortalité » : une hypothèse au cœur des politiques menées par les CDC, mais qui, notaient-ils, « n’a jamais été testée dans le cadre d’essais cliniques ».
Une étude parue en 2008 dans le Virology Journal confirme cette analyse. Contrairement aux déclarations des autorités sanitaires, elle notait que les décès et hospitalisations dus à la grippe chez les personnes âgées américaines ont fortement augmenté dans les années 1980 et 1990, précisément à l’époque où la couverture vaccinale s’envolait.
Et en 2013, dans un article publié par le BMJ, son rédacteur en chef, Peter Doshi, revenait à la charge en remettant en cause la principale justification de la politique vaccinale ciblée sur les seniors, cinglant : « Quelles sont les preuves que les vaccins contre la grippe réduisent la mortalité chez les personnes âgées ? Absolument aucune. » Et d’ajouter, non sans inquiétude : « Le plus troublant, peut-être, c’est le manque d’intérêt des autorités sanitaires face à l’absence de données fiables. »
Depuis l’arrivée de Robert F. Kennedy Jr. à la tête du ministère de la Santé en février dernier, les lignes commencent néanmoins à bouger.
Le tournant américain
Ce mois-ci, à la suite d’un vote tenu fin juin au sein du comité consultatif gouvernemental sur la vaccination, dans lequel siège le Dr Robert Malone, les États-Unis ont annoncé, le 23 juillet, la fin de l’utilisation du thimérosal, un conservateur à base de mercure, dans certains vaccins anti-grippe. « Étrangement, l’industrie et les médias de gauche militent pour injecter du mercure aux Américains », déclare le Dr Malone à Epoch Times, avant de souligner : « Et ils considèrent l’élimination de 3 % des doses de vaccin contre la grippe contenant du thimérosal comme une menace existentielle. »
Le scientifique précise que, pour cette année, le comité n’a pas eu vraiment la main sur la première résolution soumise au vote : le maintien de la recommandation d’une vaccination annuelle contre la grippe, dont la campagne débute dès le mois d’août.
« La décision a été que ce n’était pas le bon moment pour livrer bataille sur ce terrain », explique-t-il. Mais il annonce la couleur : « Je me retrouve désormais en position de président du comité sur le vaccin antigrippal. J’ai indiqué, lors de la réunion, que mon intention est de faire en sorte que ces questions — empreinte immunitaire, péché originel antigénique, etc. — soient sérieusement examinées lors des prochaines sessions. »
Les États-Unis pourraient ainsi devenir le premier pays occidental à remettre en cause la pertinence d’une vaccination antigrippale annuelle à la lumière de la littérature scientifique. A contrario, le gouvernement français, lui, entend plutôt imposer cette mesure.