Source : National Library of Medicine
Pierre Ier Parry 1, 2, * Astrid Lefringhausen 3 , Conny Turni 4 , Christopher J Neil 5 , Robyn Cosford 3 , Nicholas J Hudson 6 Julian Gillespie 3
Rédacteur en chef : Daniel López
Abstrait
La pandémie de COVID-19 a engendré de nombreuses maladies, de nombreux décès et de profondes perturbations sociales. La production de vaccins « sûrs et efficaces » constituait un objectif majeur de santé publique. Malheureusement, le taux sans précédent d’effets indésirables a éclipsé les bénéfices escomptés. Cette revue narrative en deux parties présente des preuves des effets néfastes généralisés des nouveaux vaccins anti-COVID-19 à ARNm et à ADN adénoviral. Elle innove en proposant une analyse approfondie des risques liés à cette nouvelle technologie vaccinale, qui repose sur des cellules humaines produisant un antigène étranger dont la pathogénicité est avérée. Ce premier article explore des données évaluées par des pairs qui contredisent le discours sur la « sécurité et l’efficacité » associées à ces nouvelles technologies. La pathogénicité de la protéine Spike, appelée « spikeopathie », qu’elle provienne du virus SARS-CoV-2 ou soit induite par les gènes du vaccin, à l’instar d’un « virus synthétique », est de mieux en mieux comprise en termes de biologie moléculaire et de physiopathologie. La transfection pharmacocinétique à travers les tissus, à distance du site d’injection, par des nanoparticules lipidiques ou des vecteurs viraux, implique que la « spikeopathie » peut affecter de nombreux organes. Les propriétés inflammatoires des nanoparticules utilisées pour transporter l’ARNm, l’utilisation de la N1-méthylpseudouridine pour prolonger la fonction de l’ARNm synthétique, la large biodistribution des codes ARNm et ADN et des protéines Spike traduites, ainsi que l’auto-immunité induite par la production humaine de protéines étrangères, contribuent à ces effets néfastes. Cet article passe en revue les effets auto-immuns, cardiovasculaires, neurologiques et potentiellement oncologiques de la spikeopathie, ainsi que les données d’autopsie. Face au développement de nombreuses thérapies géniques, une réévaluation s’avère nécessaire et opportune.
Mots-clés : protéine Spike, pathologie, transfection, biodistribution, nanoparticules lipidiques, autopsie, inflammation, pharmacovigilance, COVID-19, vaccins à ARNm
1. Introduction
Dans cette analyse narrative, nous examinons les preuves solides qui remettent en question le discours rassurant sur l’innocuité et l’efficacité des vaccins contre la COVID-19, développés à une vitesse fulgurante dans l’espoir d’éradiquer la pandémie. Ces preuves, désormais accumulées, ont tempéré l’optimisme initial. Leurs implications pour le diagnostic des effets indésirables liés à la vaccination et la nécessité de traitements sont importantes et doivent être prises en compte par tous les professionnels de santé et de nombreux chercheurs.
Les principaux problèmes semblent être (1) la toxicité de la protéine Spike, à la fois celle du virus et celle produite par les codes génétiques des nouveaux vaccins à ARNm et à ADN adénovectoriel contre la COVID-19 [ 1 , 2 ], d’où le nouveau terme de « spikeopathie » ; (2) les propriétés inflammatoires de certaines nanoparticules lipidiques utilisées pour transporter l’ARNm [ 3 ] ; (3) la N1-méthylpseudouridine dans l’ARNm synthétique qui provoque une action prolongée [ 4 ] ; (4) la biodistribution généralisée des codes d’ARNm [ 5 ] et d’ADN [ 6 , 7 ] via les matrices porteuses de nanoparticules lipidiques et de vecteurs viraux, respectivement ; et (5) le problème de la production par les cellules humaines d’une protéine étrangère dans nos ribosomes, ce qui peut engendrer une auto-immunité [ 8 , 9 ].
L’émergence du SARS-CoV-2 fin 2019 et la maladie associée, la COVID-19, déclarée pandémie mondiale par l’OMS en mars 2020, ont provoqué de nombreuses maladies et de nombreux décès, notamment chez les personnes âgées et les personnes à risque, et ont gravement perturbé la société. Une revue systématique de la littérature scientifique, portant sur les publications parues entre décembre 2019 et août 2021, a révélé que le risque de mortalité le plus élevé lié à la COVID-19 était associé aux maladies cardiovasculaires, aux maladies cérébrovasculaires et aux maladies rénales chroniques [ 10 ]. La production de vaccins sûrs et efficaces pour endiguer la pandémie de COVID-19 a constitué l’une des interventions de santé publique les plus importantes. De nombreux vaccins contre la COVID-19 ont été développés à travers le monde. Dans les pays non occidentaux, la plupart des vaccins ont utilisé des technologies traditionnelles à base de protéines ou de virus inactivés. Les vaccins à ARNm et à ADN adénoviral ont été produits par de grandes entreprises pharmaceutiques et sont privilégiés par les autorités réglementaires de la plupart des pays occidentaux. On a largement affirmé que ces vaccins avaient sauvé des millions de vies, et de grands espoirs ont été placés dans cette affirmation. Mais cette croyance repose en grande partie sur des estimations préliminaires du taux de létalité de l’infection (TLI) et sur les affirmations d’efficacité de Pfizer, Moderna, AstraZeneca et Janssen, qui ont été remises en cause par de nouvelles données.
L’utilisation des vaccins à base de gènes a suscité la controverse, et cet article en explore les raisons. Pour répondre à la demande généralisée de vaccins « sûrs et efficaces », la technologie génique offre une rapidité de production. L’espoir a sans doute influencé une grande partie des publications scientifiques et du discours médiatique. Un point central réside dans les preuves croissantes des effets pathogènes de la protéine Spike du SARS-CoV-2, qu’elle fasse partie intégrante du virus ou qu’elle soit produite par le code génétique des vaccins à ARNm et à ADN adénoviral.
Cette revue narrative vise à présenter un compte rendu exhaustif de la pathogénicité de l’antigène, de la biodistribution des gènes codant pour cet antigène dans l’organisme, de leur persistance prolongée, notamment avec les vaccins à ARNm, ainsi que des données et publications scientifiques relatives aux effets indésirables attendus suite à cette biodistribution et à la production cellulaire d’un antigène étranger. Elle met en lumière un cas de transfert prématuré d’une technologie de thérapie génique expérimentale à la vaccination de masse et soulève des questions éthiques et réglementaires qui nécessitent un examen approfondi et des réformes en prévision de la prochaine pandémie.
Au cœur des décisions relatives au consentement éclairé individuel et des politiques de santé publique se trouve la mise en balance des risques liés à une maladie et des risques et bénéfices potentiels d’une intervention. Compte tenu des risques associés aux nouveaux vaccins anti-COVID-19 à base de gènes, leur utilisation était-elle justifiée au regard de la gravité de l’infection par le SARS-CoV-2 ? Nous aborderons d’abord les risques liés à la COVID-19.
2. Modélisation de la COVID-19 versus données réelles
Il est clair que la souche originale de Wuhan et les premiers variants du SARS-CoV-2 en 2020 étaient plus pathogènes que les variants ultérieurs. Ceci est cohérent avec l’évolution adaptative virale typique vers des souches plus infectieuses mais moins pathogènes, un phénomène naturel bénéfique pour l’humanité. L’affirmation selon laquelle les vaccins contre la COVID-19 ont sauvé des millions de vies repose sur une modélisation basée sur les taux de létalité (TL) en Chine en février 2020, publiée par Verity et al. dans The Lancet [ 11 ]. Les auteurs ont estimé un TL de 6,4 % (5,7–7,2) chez les personnes de plus de 60 ans et « jusqu’à 13,4 % (11,2–15,9) chez les personnes de 80 ans et plus… avec un taux de létalité global pour la Chine de 0,66 % (0,39–1,33) » (résumé). Heureusement, le virus a muté et ces prédictions de modélisation ne se sont pas concrétisées au cours des trois années suivantes, durant lesquelles la pandémie s’est déroulée.
Les vaccins contre la COVID-19 ont permis de sauver des vies, mais le nombre exact reste incertain. L’affirmation selon laquelle des millions de vies auraient été sauvées grâce aux vaccins génétiquement modifiés contre la COVID-19 reposait en partie sur l’hypothèse que ces vaccins protégeaient contre l’infection et la transmission. Or, ce n’était pas le cas, car l’immunité systémique contre les virus respiratoires est moins efficace que l’immunité muqueuse, et en raison de l’évolution constante des variants, peut-être en partie due à l’échappement adaptatif aux anticorps induits par la vaccination. Pfizer a reconnu que son essai clinique de phase 3 [ 12 ] n’avait pas évalué la transmission virale [ 13 ].
Cependant, les présomptions d’efficacité ont été entretenues par les modélisateurs de la COVID-19 et réitérées par les autorités sanitaires, les publications médicales et les médias. C’est le cas de l’étude de Watson et al. (2022) intitulée « Impact mondial de la première année de vaccination contre la COVID-19 : une étude de modélisation mathématique », publiée dans The Lancet Infectious Diseases [ 14 ]. Les auteurs estiment à environ 14,4 millions le nombre de vies sauvées grâce aux bénéfices de la vaccination, notamment la protection contre l’infection et la transmission, deux affirmations aujourd’hui reconnues comme infondées. Cette estimation hypothétique de Watson et al. persiste comme une vérité établie, alors que les données réelles sur le taux de létalité de l’infection (TLI) démontrent l’inutilité de la vaccination chez les personnes non âgées.
En bref, Roussel et al. ont présenté début 2020 une analyse statistiquement significative comparant le taux de létalité du SARS-CoV-2 à celui d’autres coronavirus et de syndromes grippaux : dans les pays de l’OCDE, le taux de mortalité du SARS-CoV-2 (1,3 %) n’était pas significativement différent de celui des coronavirus courants identifiés dans les hôpitaux publics de Marseille (0,8 % ; p = 0,11) [ 15 ]. Si la modélisation avait été basée sur ces données quelques mois après les premières données chinoises, des projections différentes auraient été établies, plus conformes aux statistiques de mortalité finales, y compris celles de 2020, avant la mise à disposition de tout vaccin.
En 2022, dans un article intitulé « Les prévisions concernant la COVID-19 ont échoué », Ioannidis et al. ont critiqué les modèles qui ignoraient les faibles taux de létalité observés au cours du premier semestre 2020 [ 16 ]. Ioannidis et al. ont notamment souligné :
« L’échec des prévisions épidémiques est un problème ancien. De fait, il est surprenant que ces prévisions aient conservé une telle crédibilité auprès des décideurs, compte tenu de leurs résultats douteux. Les modèles prévoyant la grippe porcine tablaient sur 3 100 à 65 000 décès au Royaume-Uni ( https://www.theguardian.com/uk/2009/jul/16/swine-flu-cases-rise-britain , consulté le 2 juin 2020). Finalement, on a dénombré 457 décès (gouvernement britannique, 2009) . »
[ 16 ] (p. 425)
Ioannidis et al. ont ensuite examiné de nombreux modèles de prédiction américains de la COVID-19 concernant les décès, les hospitalisations et les admissions en soins intensifs, soulignant les marges extrêmement importantes qui les empêchaient d’atteindre leurs objectifs. Ioannidis et al. ont poursuivi :
« Malgré ces échecs manifestes, les prévisions épidémiques [de la COVID-19] ont continué de prospérer, peut-être parce que les prédictions largement erronées n’avaient généralement pas de conséquences graves… Dès lors que l’on dispose de données probantes solides sur les caractéristiques épidémiologiques des nouvelles épidémies, les prévisions invraisemblables et exagérées (Ioannidis, 2020d) devraient être abandonnées. Autrement, elles risquent de faire plus de mal que le virus lui-même . »
[ 16 ] (p. 428)
Les récits sociétaux, une fois enracinés, deviennent difficiles à modifier.
Pour estimer avec précision le nombre de vies sauvées ou perdues grâce aux vaccins génétiquement modifiés contre la COVID-19, il aurait fallu mener des études à long terme comparant les personnes vaccinées aux personnes non vaccinées. Pfizer, Moderna, AstraZeneca et Janssen ont finalement vacciné la quasi-totalité des participants du groupe placebo, perdant ainsi leur groupe témoin. Cette décision était motivée par des principes éthiques, compte tenu de la crainte liée à la COVID-19 [ 17 a souligné le manque de rigueur scientifique lié à l’absence d’essais contrôlés par placebo à court terme . ]. Toutefois, le Groupe d’experts ad hoc de l’OMS sur les prochaines étapes de l’évaluation de la COVID-19 (2020) [ 18 ]
Pour pallier ce manque, une organisation privée basée au Royaume-Uni, Control Group Cooperative [ 19 ], collecte des données depuis le début de la campagne de vaccination contre la COVID-19 et constitue le seul groupe témoin à l’échelle mondiale. Parmi cette cohorte non vaccinée, 18 497 personnes ont participé à une enquête portant sur les tests positifs à la COVID-19 et la gravité des symptômes entre septembre 2021 et février 2022. Un quart (4 636, soit 25,1 %) a déclaré avoir présenté des symptômes de la COVID-19. Ces symptômes ont été qualifiés de « légers » par 14,4 %, de « modérés » par 8,7 % et de « graves » par 2 %. Par ailleurs, 560 personnes ont déclaré être asymptomatiques. Sur les 5 196 personnes atteintes de la COVID-19, seules 74 (1,4 %) ont déclaré avoir consulté un médecin (en hospitalisation ou en ambulatoire), dont 21 (0,4 %) pendant plus d’une semaine. Cette enquête étant déclarative, elle présente certaines limites, notamment le risque de non-déclaration de certains décès. Néanmoins, la cohorte a obtenu de meilleurs résultats que prévu. Ce groupe était peut-être inhabituel en ce sens que 71 % de ses membres ont pris une combinaison de vitamines C, D, de quercétine, de zinc et d’ivermectine ou d’hydroxychloroquine hors AMM lorsque cela était possible. 20 ].
Dans ce contexte, les données sanitaires de l’État australien de Nouvelle-Galles du Sud (NSW) pour novembre et décembre 2022 [ 21 ] ( figures 1 et 2 ) montrent que les personnes non vaccinées sont quasiment sous-représentées parmi les hospitalisations, tandis que les personnes les plus vaccinées y sont surreprésentées. La proportion de personnes non vaccinées en NSW était faible (3,2 %) ; cependant, la proportion de personnes non vaccinées atteintes d’une forme grave de COVID-19 était encore plus faible fin 2022 (2,9 %). Même en tenant compte des doses de rappel administrées aux personnes âgées et vulnérables, les données ne suggèrent pas d’efficacité significative du vaccin contre la COVID-19 en termes d’hospitalisation, d’admission en soins intensifs et de décès, du moins après l’émergence de la souche Omicron.
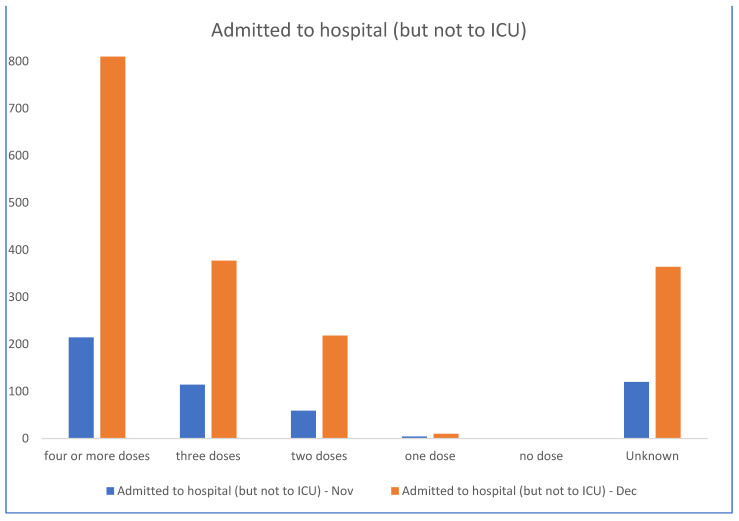
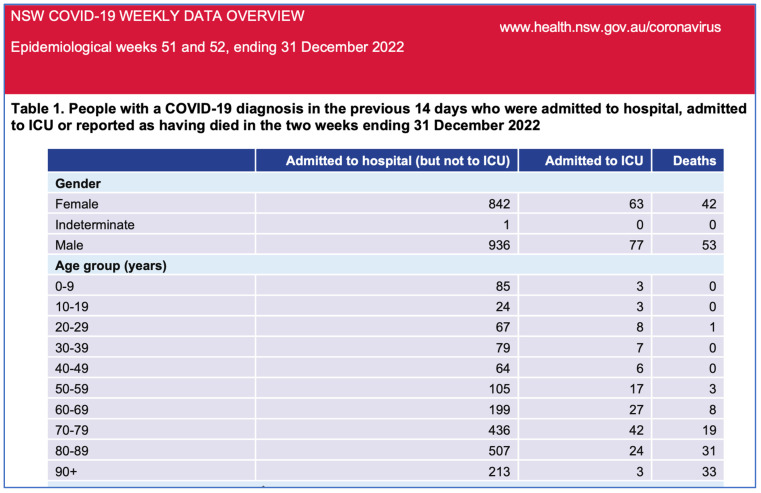
Pour les semaines 51 et 52 de 2022, les données du gouvernement de Nouvelle-Galles du Sud font état de zéro hospitalisation et de six décès chez les personnes non vaccinées, contre 1 415 hospitalisations et 82 décès chez les personnes vaccinées. Le ministère de la Santé de Nouvelle-Galles du Sud ne publie plus les informations relatives à la vaccination. Ces données ne confirment pas l’affirmation selon laquelle la vaccination aurait « sauvé des millions de vies », mais suggèrent plutôt une corrélation entre un plus grand nombre de doses vaccinales et une forme grave de la COVID-19, ce qui justifie des investigations supplémentaires. On observe une augmentation de la mortalité toutes causes confondues, concomitante au déploiement des vaccins anti-COVID-19 à thérapie génique, et ce phénomène justifie des recherches plus approfondies.
Les modèles mathématiques produisent des chiffres très incertains qui prédisent l’avenir. Ces prédictions peuvent être instrumentalisées à des fins politiques. Afin d’éviter qu’elles ne deviennent des outils au service d’une cause politique, les modélisateurs, les décideurs et les citoyens doivent s’appuyer sur des faits concrets pour garantir notre responsabilité collective.
Si les vaccins contre la COVID-19 s’avèrent moins efficaces qu’espéré et annoncé, l’évaluation du rapport bénéfice/risque pour le consentement éclairé individuel et les politiques de santé publique s’en trouvera modifiée. Les risques liés à cette nouvelle technologie vaccinale génique pourraient alors être supérieurs aux bénéfices escomptés.
3. Correspondance entre TGA et le sénateur australien Rennick
En Australie, la Therapeutic Goods Administration (TGA) a provisoirement approuvé les vaccins contre la COVID-19 de Pfizer (Comirnaty, BNT162b2), Moderna (SPIKEVAX, mRNA-1273), AstraZeneca (Vaxzevria, ChAdOx1 nCOV-19) et Janssen (COVID-19 Vaccine, Ad26.COV2.S) début 2021 [ 22 ] et a ajouté en janvier 2022 le vaccin à base de protéines et de nanoparticules lipidiques de Novavax (Nuvaxovid, NVX-CoV2373) [ 23 ].
Le 16 décembre 2022, le ministère australien de la Santé, conseillé par la TGA, a répondu à la question 235 du 21 novembre 2022 posée par le sénateur Gerard Rennick (Parti libéral, Qld) dans le cadre de la question sur avis SQ22-000609 du Comité sénatorial des affaires communautaires. Le sénateur Rennick, dont le bureau parlementaire a reçu de nombreux témoignages d’Australiens faisant état d’effets indésirables liés à la vaccination contre la COVID-19, avait demandé si le propre rapport de la TGA [ 5 ] qui montrait des taux élevés de transfection et d’expression largement biodistribués des vaccins à ARNm contre la COVID-19 à base de gènes, prouvait que les vaccins étaient plus pathogènes que le virus, impliquant une charge plus importante de protéine Spike sur les cellules humaines [ 24 ].
La TGA a répondu :
« Il règne une certaine confusion concernant la biochimie et l’immunologie dans ce contexte. Un taux de traduction et d’expression plus élevé n’est pas associé à la pathogénicité ; il indique plutôt une meilleure expression de l’antigène (protéine Spike). La protéine Spike exprimée n’est pas pathogène et n’est pas infectieuse. La protéine Spike n’est qu’un composant du coronavirus. Elle sert d’antigène pour induire des réponses immunitaires humorales et cellulaires contre le virus SARS-CoV-2 . »
[ 24 ]
En tant qu’auteurs australiens de cet article, nous partageons l’avis de la TGA selon lequel la protéine Spike produite par les vaccins anti-COVID-19 issus de la thérapie génique agit comme un antigène induisant une réponse immunitaire et n’est pas un agent pathogène à part entière. Cependant, la réponse de la TGA est incomplète. Nous résumerons ici les données démontrant que la protéine Spike est bio-active et pathogène de manière indépendante. Cette protéine est directement impliquée à la fois dans la physiopathologie de la COVID-19 et dans les effets indésirables graves des vaccins anti-COVID-19 qui, par le biais de mécanismes de thérapie génique, induisent les cellules humaines à produire cette protéine en grande quantité.
De fait, la protéine Spike de l’épidémie initiale de SRAS-CoV-1 en 2003 a été identifiée comme une cause de lésions pulmonaires, à l’origine du terme « syndrome respiratoire aigu sévère » (SRAS). On pensait alors qu’elle agissait sur les récepteurs de l’enzyme de conversion de l’angiotensine 2 (ACE2). La régulation négative des récepteurs ACE-2 induite par la protéine Spike du SARS-CoV-1 (virus de 2003) a conduit à un œdème pulmonaire et à une insuffisance pulmonaire aiguë chez les souris, comme publié dans Nature Medicine [25].
4. Méthodologie de l’analyse narrative
Nous présentons ici une revue narrative de la littérature qui met en évidence la toxicité, et donc la pathogénicité, de la protéine Spike, indépendamment de son rôle de déterminant pathogène dans l’infection par le SARS-CoV-2. Ceci concerne les vaccins contre la COVID-19 utilisant un adénovirus (AstraZeneca et Janssen) ou produits par le code génétique dans les cellules humaines, soit directement par ARNm (Pfizer et Moderna), soit par ARNm dérivé de l’ADN adénoviral.
Nous examinons également les données de la littérature concernant la toxicité et le profil de biodistribution préoccupants des matrices lipidiques-nanoparticules des vaccins contre la COVID-19 à ARNm de Moderna et Pfizer et à base de protéines de Novavax ; la nature modifiée de l’ARNm synthétique qui expliquerait la persistance prolongée de l’ARNm et la production de la protéine Spike ; le phénomène de variation des « lots défectueux » dans les rapports d’événements indésirables et les considérations pertinentes relatives aux risques et aux avantages stratifiés par âge pour la vaccination contre la COVID-19, en particulier pour les cohortes d’âge pédiatriques et les jeunes adultes.
Ces aspects pharmacocinétiques et pharmacodynamiques sont liés à la pathogénicité des vaccins anti-COVID-19 à base de gènes. Dans le contexte de la réponse de la TGA mentionnée ci-dessus, les aspects pharmacocinétiques et de biodistribution de ces vaccins sont comparables à ceux d’un agent infectieux, en phase invasive ou véhiculée par le sang, puisqu’ils diffusent les effets pathogènes de la protéine Spike dans tout l’organisme.
Cette revue présente des données issues de la littérature scientifique, de la pharmacovigilance et des documents d’essais cliniques de Pfizer, obtenus grâce à des demandes d’accès à l’information (DAI), afin d’aider la TGA et d’autres organismes de réglementation et autorités sanitaires à réévaluer la toxicité des protéines Spike produites par ARNm et ADN adénovectoriel. Une nouvelle pathologie, que l’on pourrait qualifier de « spikeopathie », se dessine. Il est également essentiel d’évaluer le risque d’apparition de nouveaux phénomènes auto-immuns induits par la production d’antigènes étrangers via toute nouvelle technologie à base d’ARNm ou d’ADN.
Les preuves des dommages causés par la « spikeopathie », ainsi que d’autres formes de lésions physiopathologiques, sont examinées par système d’organes, tandis qu’un examen des données de pharmacovigilance fera l’objet d’un autre article.
Les points clés ci-dessous résument les informations présentées.
Points clés
- Des vaccins hautement sûrs et efficaces sont essentiels pour lutter contre les épidémies/pandémies de maladies infectieuses.
- La protéine Spike du SARS-CoV-2 est pathogène, qu’elle provienne du virus ou qu’elle soit créée à partir du code génétique des vaccins à ARNm et à ADN adénovectoriel.
- Les données d’études de biodistribution chez les rongeurs montrent que les nanoparticules lipidiques transportent l’ARNm vers tous les organes et traversent les barrières hémato-encéphalique et hémato-placentaire. Certains de ces tissus sont probablement imperméables à l’infection virale ; par conséquent, le risque biologique est particulièrement lié à la vaccination.
- Les nanoparticules lipidiques ont des propriétés inflammatoires.
- La modification de l’ARNm par la N1-méthylpseudouridine, visant à accroître sa stabilité, permet la production de protéines de spicule pendant plusieurs mois. Le nombre de cellules et les organes impliqués dans la production de ces protéines de spicule restent inconnus ; par conséquent, la dose efficace exacte administrée par flacon de vaccin est également inconnue.
- Le devenir à long terme de l’ARNm au sein des cellules est actuellement inconnu.
- Les vaccins à ARNm et à ADN adénovectoriel agissent comme des « virus synthétiques ».
- Chez les jeunes et les personnes en bonne santé, et même chez de nombreuses personnes âgées présentant des comorbidités vulnérables, les vaccins contre la COVID-19 basés sur le codage génétique transfecteront probablement un ensemble de tissus beaucoup plus diversifié que l’infection par le virus lui-même.
- Des données suggèrent que la transcription inverse de l’ARNm en une copie d’ADN est possible. Ceci laisse entrevoir la possibilité d’une transmission intergénérationnelle si les cellules germinales incorporent cette copie d’ADN dans le génome de l’hôte.
- La production de protéines étrangères, telles que la protéine Spike, à la surface des cellules peut induire des réactions auto-immunes et des lésions tissulaires. Ceci a des conséquences très négatives pour tout futur médicament ou vaccin à base d’ARNm.
- La protéine Spike exerce ses effets physiopathologiques (« spikeopathie ») via plusieurs mécanismes qui conduisent à une inflammation, une thrombogenèse, des lésions tissulaires liées à l’endothélite et une dérégulation liée aux prions.
- L’interaction de la protéine Spike codée par le vaccin avec ACE-2, P53 et BRCA1 suggère un large éventail d’interférences biologiques possibles avec le potentiel oncologique.
- Les données relatives aux événements indésirables provenant des bases de données officielles de pharmacovigilance, un rapport FDA-Pfizer obtenu via la loi sur la liberté d’information, montrent des taux élevés et de multiples systèmes organiques touchés : principalement les systèmes neurologique, cardiovasculaire et reproducteur.
- Les données des essais cliniques des vaccins à ARNm contre la COVID-19 de Pfizer et Moderna, interprétées indépendamment, ont fait l’objet d’une évaluation par les pairs et ont été publiées. Elles démontrent un rapport bénéfice/risque défavorable, notamment chez les personnes non âgées. Chez les enfants, les risques sont nettement supérieurs aux bénéfices.
- Les doses de rappel répétées du vaccin contre la COVID-19 semblent induire une tolérance et pourraient contribuer à la réinfection par la COVID-19 et au « COVID long ».
- La pandémie de SARS-CoV-2 a révélé des lacunes dans les agences de réglementation de la santé publique et des médicaments.
- Une analyse des causes profondes est nécessaire pour ce qui apparaît désormais comme une réponse précipitée à une pandémie alarmante de maladie infectieuse.
- Les modalités de traitement des pathologies liées à la « spikeopathie » dans de nombreux systèmes organiques nécessitent des recherches urgentes et une mise à disposition pour des millions de personnes souffrant d’effets indésirables à long terme du vaccin contre la COVID-19.
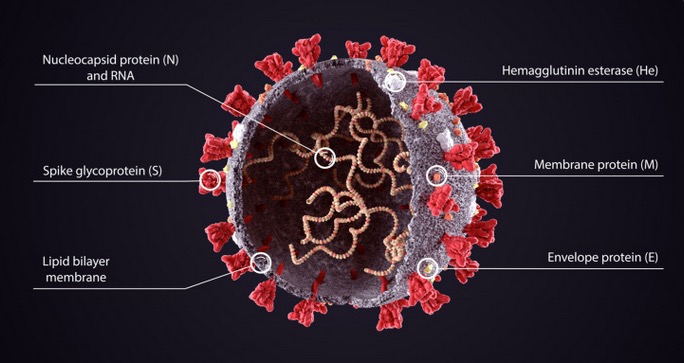
5. Structure de la protéine Spike du SARS-CoV-2
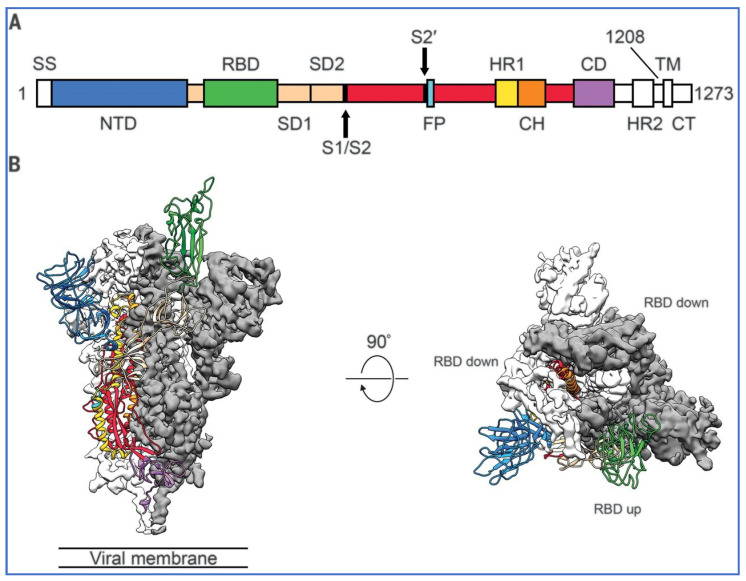
La microscopie électronique cryogénique (cryo-EM) a révélé la structure de la protéine Spike dès le début de la pandémie [ 26 ]. Les protéines Spike du SARS-CoV-2 font saillie à partir de la paroi cellulaire du virus et sont représentées en rouge sur le schéma de la figure 3 de Cuffari [ 27 ].
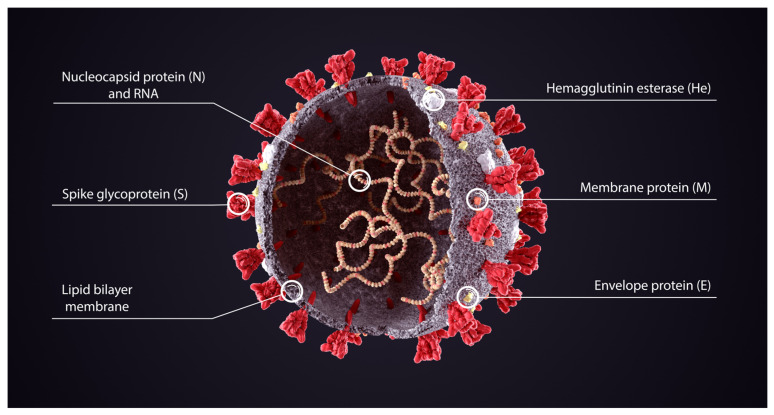
Dans le contexte de l’infection par le SARS-CoV-2, la protéine Spike est un déterminant pathogène de l’invasion cellulaire, composée de deux sous-unités : S1 à l’extrémité distale de la glycoprotéine Spike pointant vers l’extérieur du virus, constituée d’un domaine N-terminal (NTD) et d’un trimère de trois domaines de liaison au récepteur (RBD), et S2 constituée principalement d’une région C-terminale qui forme la tige de la protéine Spike et s’insère à proximité de l’enveloppe ou de la membrane du virus.
Le virus utilise la protéine Spike pour se lier aux récepteurs ACE-2 à la surface des cellules et y pénétrer. Pour ce faire, le domaine de liaison au récepteur (RBD) de la sous-unité S1 subit une extension en forme de charnière, passant d’une position « bas » à une position « haut », afin d’interagir avec le récepteur ACE-2.
La figure 4 , extraite de Wrapp et al. [ 26 ], montre l’un des trois RBD « trimériques » en vert, en position « haute », tandis que les deux autres RBD sont en position « bas » et inaccessibles à la liaison à l’ACE-2. Le schéma de gauche représente la protéine Spike de profil et celui de droite, la sous-unité S1, ou partie supérieure de la protéine Spike trimérique, vue de dessus.
5.1. La protéine Spike produite par le vaccin possède-t-elle des RBD fermés protecteurs ?
Le virion du SARS-CoV-2 porte la protéine Spike sous forme de trimères, principalement en conformation de préfusion. Ces trimères de protéine Spike en préfusion présentent différentes conformations : soit fermées, avec les trois domaines de liaison au récepteur (RBD) repliés à l’extrémité de la protéine Spike, soit ouvertes, avec un ou plusieurs RBD faisant saillie à l’extrémité de la protéine Spike. Le site de liaison au récepteur (RBS) est largement inaccessible lorsque les RBD sont repliés. La protéine Spike contient un site de clivage par la furine, permettant sa scission en sous-unités S1 et S2, ce qui favorise l’infectiosité. La sérine protéase est nécessaire à cette scission, qui augmente considérablement l’infectiosité via le récepteur ACE2.
Après interaction avec le récepteur, la protéine Spike subit un réarrangement conformationnel entraînant l’exposition de la sous-unité S2, l’insertion du peptide de fusion dans la membrane de la cellule cible et le repliement de S2. Ce repliement rapproche le peptide de fusion et le domaine transmembranaire de la protéine Spike, attirant ainsi les membranes de la cellule cible et du virus et provoquant leur fusion. Par analogie, imaginez un ouvre-bouteille tirant le bouchon par le goulot – sauf que le bouchon est relié à une membrane cellulaire qui est tirée vers le haut en même temps que lui [ 28 ].
Les vaccins commercialisés en Australie reposent sur des mutations génétiques de la protéine Spike, conçues pour stabiliser l’état de préfusion et réduire la transition vers la forme post-fusion, limitant ainsi le clivage. Ces mutations consistent notamment à remplacer deux résidus par une double proline (par exemple, Pfizer/BioNTech, Moderna, Novavax et Janssen) ou à modifier le site de clivage par la furine pour conférer une résistance aux protéases (Janssen).
Au vu des données accumulées qui suggèrent que les protéines de pointe créées par l’ARNm et l’ADN adénovectoriel sont nocives, ces mécanismes de protection théoriques semblent avoir échoué.
Plusieurs raisons peuvent expliquer l’échec de ce système. Étant donné que seule l’ARNm, et non la protéine Spike complète, est injectée avec les nanoparticules lipidiques, il est possible que les fragments d’ARNm soient incomplets, en raison d’une synthèse sous-optimale ou d’une dégradation post-fabrication. La protéine Spike pourrait alors être exprimée partiellement sous forme de protéine Spike tronquée, présentant une conformation permettant son clivage en un peptide et une sous-unité S1 ou S2 fonctionnelle.
Même avec une expression complète du code protéique, un clivage partiel peut subsister au sein des cellules. Aucun système biologique n’est efficace à 100 %, et la mutation vise uniquement à réduire, et non à empêcher totalement, le clivage en S1 et S2. Le transport des protéines de spicule ou de leurs sous-unités via les exosomes, la fusion cellulaire directe et les tunnels de nanotubes vers d’autres cellules demeure possible. Des erreurs d’expression intracellulaires pourraient permettre aux protéines de spicule de conserver certaines fonctions. La contamination par des vecteurs plasmidiques capables de se répliquer offre la possibilité d’une mutation lors de la réplication ou d’une insertion dans le génome.
La protéine Spike est non seulement toxique par liaison aux récepteurs ACE2, mais elle exerce également des effets cytotoxiques intracellulaires via son interaction avec les gènes suppresseurs de tumeurs BRCA et P53 et des lésions mitochondriales, des coagulopathies par contact direct avec les protéines cellulaires, et une neurotoxicité due à son accumulation, avec dissémination et reconfiguration des protéines prions en leur forme pathologique. L’accumulation de la protéine Spike à l’intérieur des cellules pourrait avoir des effets toxiques et apoptotiques [ 29 ].
5.2. Domaine de type toxine dans le RBD
Un autre mécanisme de pathogénicité a été récemment mis en évidence. Il a été montré que la protéine Spike contient également un domaine de type toxine dans le RBD de la sous-unité S1, présentant une homologie de séquence avec les glycoprotéines du virus de la rage (RBG) et du VIH, ainsi qu’avec la neurotoxine NL-1. Toutes ces protéines se lient aux récepteurs nicotiniques de l’acétylcholine α7 (α7 nAChR) du système cholinergique [ 30 ]. La neurotoxine NL-1 est une neurotoxine, un type de venin de serpent, et est similaire à la bungarotoxine, un inhibiteur connu des récepteurs α7 nAChR, présentant une forte affinité de liaison. Les neurotoxines à trois doigts du venin de serpent (α-3FNTx) agissent sur les récepteurs nicotiniques de l’acétylcholine postsynaptiques (nAChR) à la jonction neuromusculaire (NMJ) pour produire une paralysie des muscles squelettiques et sur des nACHR spécifiques à d’autres sites [ 31 ], ce qui entraîne des perturbations dans le contrôle de l’inflammation [ 32 ].
Ce domaine de liaison de type toxine Spike fait partie du RBD, adjacent au site de liaison du récepteur ACE, et il a été démontré, tant par simulation informatique [ 32 ] que par des études électrophysiologiques, qu’il se lie préférentiellement au récepteur nicotinique α7 (α7 nAChR) à des doses nanomolaires, à l’instar de neurotoxines telles que la bungarotoxine. Le peptide actif SCoV2P potentialise et inhibe les réponses du récepteur α7 nAChR induites par l’acétylcholine (ACh) par un mécanisme allostérique potentiel à des puissances nanomolaires, et la nicotine renforce ces effets. À faibles doses, elle potentialise et à doses plus élevées, elle inhibe la fonction du récepteur α7 nAChR [ 33 ].
Ce modèle de liaison pourrait fournir des explications logiques aux troubles inflammatoires aigus et à d’autres affections chez les patients atteints de COVID-19, de COVID long et de lésions vaccinales, qui pourraient être liées à une grave dérégulation du système nerveux central.
6. Motifs d’inquiétude : aspects pharmacodynamiques, pharmacocinétiques et physiopathologiques
Les données pharmacocinétiques et pharmacodynamiques soulèvent des inquiétudes quant à la conception des vaccins contre la COVID-19 à ARNm et à ADN adénoviral et permettent de mieux comprendre la physiopathologie désormais largement documentée. On observe une biodistribution incontrôlée, ainsi qu’une persistance et une biodisponibilité accrues de la protéine Spike.
6.1. Les vaccins à base de gènes constituent une technologie expérimentale novatrice
Le nombre sans précédent d’effets indésirables semble lié aux protéines de pointe produites par les technologies génétiques utilisées par Pfizer, Moderna, AstraZeneca et Johnson & Johnson. La technologie de l’ADN à vecteur viral est également employée dans les vaccins anti-COVID-19 Spoutnik V et EpiVacCorona en Russie, iNCOVACC en Inde et Convidecia en Chine. Cependant, la majorité des vaccins contre la COVID-19, principalement produits dans des pays non occidentaux, sont des vaccins traditionnels à base de protéines ou des vaccins non génétiques à virus inactivé [ 34 , 35 ].
Les vaccins contre la COVID-19 à base de gènes appartiennent à une catégorie particulière d’agents thérapeutiques définis par la FDA comme des « produits de thérapie génique » [ 36 ]. Dans ce contexte, les cellules cibles produisent des antigènes destinés à une expression transmembranaire ou à quitter la cellule, induisant ainsi une réponse immunitaire secondaire. De ce fait, en employant un mécanisme d’invasion de type viral et de détournement de la transcription cellulaire, les vaccins à ARNm et à ADN adénoviral transforment de facto des cellules non immunitaires en cellules présentatrices d’antigènes, par leur mode d’immunogénicité. Par conséquent, ces nouvelles plateformes vaccinales présentent un risque de lésions tissulaires secondaires à des réponses auto-immunes cytopathiques, dirigées contre des cellules exprimant des antigènes de spicule étrangers.
Avant la pandémie de SARS-CoV-2, l’utilisation de cette technologie était expérimentale et principalement limitée à la production de protéines pour le traitement du cancer métastatique. Aucun vaccin à ARNm n’avait été autorisé pour un usage public avant la pandémie de COVID-19 [ 37 ] et les vaccins à ADN à vecteur viral n’avaient qu’un usage limité contre Ebola, la dengue et l’encéphalite japonaise [ 38 ].
Des documents obtenus grâce à une demande d’accès à l’information (DAI) révèlent que les vaccins à ARNm contre la COVID-19 ont été développés dans le cadre du programme « Operation Warp Speed » de l’administration Trump, sous l’égide du département de la Défense des États-Unis. Ces vaccins issus de la thérapie génique constituaient des « contre-mesures » d’urgence face à une menace pour la sécurité nationale, menace que la pandémie a sans doute initialement représentée en 2020. De ce fait, de nombreux protocoles d’essais de sécurité et de toxicologie de la FDA, habituellement longs et complexes, ont été contournés afin d’obtenir rapidement l’autorisation d’utilisation d’urgence [ 39 , 40 , 41 ].
6.2. Large distribution des nanoparticules lipidiques
Turni et Lefringhausen [ 42 ], dans « Vaccins contre la COVID-19 — Revue australienne » , soulignent que la nanoparticule lipidique, vecteur de l’ARNm synthétique, est potentiellement inflammatoire, traverse les membranes et se distribue largement dans l’organisme. Elle franchit à la fois la barrière hémato-encéphalique et la barrière hémato-placentaire. Ils citent le rapport de l’EMA sur le vaccin Moderna, indiquant que « l’ARNm a pu être détecté dans le cerveau après administration intramusculaire à une concentration d’environ 2 % de celle retrouvée dans le plasma » (p. 491). Ils citent également des travaux de recherche [ 43 , 44 , 45 ] décrivant comment et pourquoi les nanoparticules lipidiques traversent facilement la barrière hémato-encéphalique.
Le professeur agrégé Byram Bridle, virologue et vaccinologue canadien, a obtenu les données de biodistribution d’une étude Pfizer sur les rongeurs auprès de l’Agence japonaise des produits pharmaceutiques et des dispositifs médicaux (PMDA) par le biais d’une demande d’accès à l’information en 2021 [ 46 ]. Judicial Watch, une fondation américaine indépendante de surveillance, a obtenu le même rapport d’étude Pfizer en intentant une action en justice au titre de la loi sur la liberté d’information auprès du département américain de la Santé et des Services sociaux, après le refus de la FDA et des CDC de se conformer à la demande [ 47 ]. Une demande d’accès à l’information plus récente adressée à l’Agence australienne des produits thérapeutiques (réponse 2389-6) révèle, à la page 45 du rapport d’évaluation non clinique du vaccin BNT162b2 contre la COVID-19, que cette même étude avait été prise en compte par l’Agence australienne des produits thérapeutiques en janvier 2021, avant son autorisation provisoire [ 5 ] (p. 45).
L’étude de biodistribution de Pfizer a porté sur 63 rats Wistar Han, dont 42 (21 mâles et 21 femelles) ont reçu une injection de l’équivalent humain de 50 µg d’ARNm par animal, et 21 rats mâles supplémentaires ont reçu une injection de l’équivalent d’une dose du vaccin Moderna contre la COVID-19, soit 100 µg d’ARNm par animal. L’ARNm codant pour la luciférase a été encapsulé dans des nanoparticules liquides contenant du cholestérol radiomarqué, injecté dans le muscle fessier et suivi pendant 48 h. Comme indiqué sur la figure 5 , les données de biodistribution ont montré que les nanoparticules lipidiques, conçues pour traverser facilement les tissus et les membranes biologiques, se sont distribuées dans tous les organes. Après 48 h, 75 % d’entre elles avaient quitté le site d’injection pour se diffuser ailleurs [ 5 , 47 ].
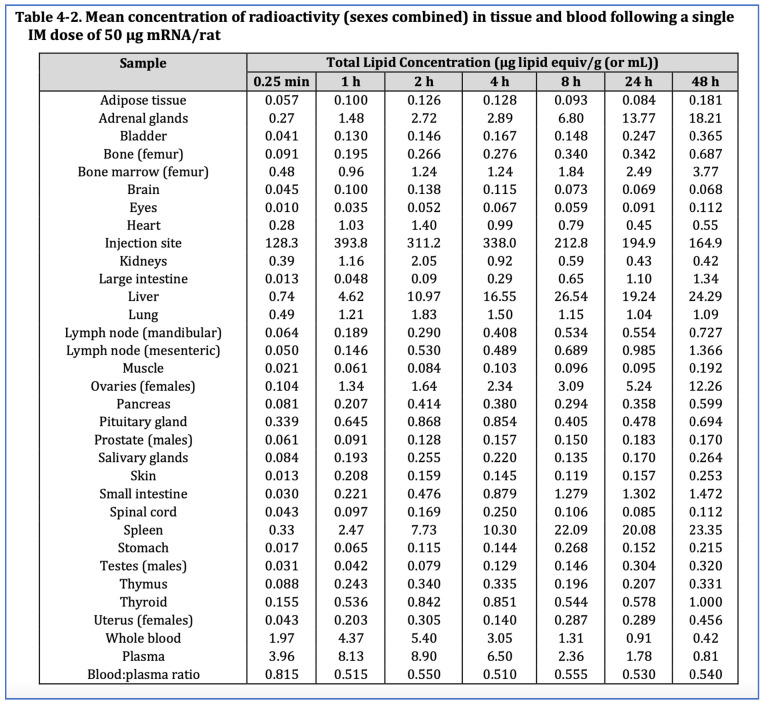
Bien que les concentrations les plus élevées aient été observées dans la rate et le foie, où le renouvellement cellulaire rapide contribue à la réparation rapide de tout dommage cytotoxique, les nanoparticules lipidiques, et par conséquent l’ARNm, se sont retrouvées dans presque tous les organes, notamment les ovaires et les glandes surrénales, mais aussi le cerveau, les yeux, le cœur, les testicules, l’utérus, l’hypophyse, la moelle épinière, le thymus et la moelle osseuse.
L’étude de biodistribution chez le rat menée par Pfizer a été corroborée. Des chercheurs chinois ont injecté à des souris des complexes lipides-nanoparticules-ARNm (ARNm-LNP) codant pour le gène de la luciférase de luciole. La biodistribution à partir du site d’injection a montré une distribution rapide dans tout l’organisme, avec une forte concentration dans le foie. La relation non linéaire entre l’exposition aux LNP et le niveau d’expression protéique varie selon les tissus et les organes [ 48 ] (p. 114). Des complexes ARNm-LNP plus petits ont été transfectés plus profondément, et des quantités relativement plus faibles d’ARNm dans le foie et les ganglions lymphatiques ont produit des taux de protéine bioluminescente codée plus élevés qu’au niveau du muscle, site d’injection. Les auteurs ont déclaré :
« La durée et la cinétique de l’expression du transgène sont influencées par la pharmacocinétique et la biodistribution des systèmes d’administration. La relation pharmacocinétique-pharmacodynamique des LNP-ARNm est très complexe, ce qui rend improbable la prédiction de l’expression génique et de l’efficacité (pharmacodynamique) basée uniquement sur l’exposition aux LNP dans les tissus (pharmacocinétique) . »
[ 46 ] (pp. 112–113)
En effet, la nanoparticule lipidique, et vraisemblablement sa charge utile d’ARNm, se répartit dans tout le corps et l’expression des gènes varie de manière imprévisible [ 5 , 46 , 48 ].
6.3. ARNm de pseudouridine à longue durée de vie
L’ARN messager naturel étant très instable, l’ARNm synthétique codant pour la protéine Spike des vaccins contre la COVID-19 de Moderna et Pfizer a été stabilisé par remplacement de l’uridine par la N1-méthylpseudouridine [ 37 ]. Cette modification confère à l’ARNm synthétique une stabilité excessive sur une période prolongée [ 49 ]. Fertig et al. [ 50 ] ont constaté que les nanoparticules lipidiques et l’ARNm qu’elles contenaient circulaient encore dans le plasma sanguin 15 jours après la vaccination. Des recherches récentes ont mis en évidence la présence d’ARNm dans le plasma sanguin 28 jours après la vaccination [ 51 ]. De plus, une étude menée au Brigham and Women’s Hospital auprès de 13 infirmières vaccinées avec le vaccin à ARNm contre la COVID-19 de Moderna a révélé que la sous-unité S1 recirculait en quantités picomolaires, en même temps que la protéine Spike entière, pendant une période de 42 à 72 heures environ [ 52 ].
Röltgen et al. [ 53 ] ont observé la persistance, pendant toute la durée de leur étude (60 jours), de l’ARNm et des protéines Spike libres dans le cytoplasme et les noyaux des cellules germinales des ganglions lymphatiques axillaires ipsilatéraux au site d’injection dans le muscle deltoïde. La protéine Spike persistait dans le sang de 96 % des personnes vaccinées jusqu’à deux jours après la vaccination et était encore présente chez 63 % d’entre elles une semaine après la première dose. Après la deuxième dose, la détection de la protéine Spike « est entravée… probablement en raison… d’anticorps anti-Spike » (p. 1037). Cependant, comme démontré précédemment, les molécules d’ARN modifiées sont extrêmement stables et, tant qu’elles persistent à l’intérieur de la cellule et que celle-ci n’est pas attaquée et détruite par le système immunitaire, la production intracellulaire de la protéine Spike ribosomique se poursuit. Aucune étude n’a déterminé la stabilité de la protéine Spike induite par le vaccin, mais la protéine Spike libre a été trouvée circulant jusqu’à 19 jours après la vaccination dans le plasma de jeunes individus atteints de myocardite post-vaccinale [ 54 ].
Les implications des résultats de Röltgen et al. [ 53 ] ont été détaillées dans un article de blog de Jikomes [ 55 ], qui les considère comme un signe de danger. À l’inverse, un article de blog de Yong [ 56 ] soutient que la présence prolongée d’ARNm et de protéines Spike n’est pas dangereuse. Yong concède toutefois que cette persistance était inattendue. Les autorités sanitaires avaient assuré aux cliniciens et au public, dès le début du déploiement du vaccin contre la COVID-19, que la persistance de la production d’ARNm et de protéines Spike serait brève et localisée au deltoïde. Or, ce n’est manifestement pas le cas, et les implications biologiques de la traduction persistante de la protéine Spike dans différents types de tissus méritent d’être étudiées.
Les résultats de ces études sont cohérents avec la demi-vie de 14 jours du mRNA-LNP dans l’étude de biodistribution sur rat Pfizer du ministère japonais de la Santé [ 46 ] et sont résumés dans le tableau 1 .
Tableau 1.
Des études démontrant la persistance des constituants du vaccin à base de vecteur et/ou de la protéine de pointe dérivée.
| Auteur | Constituants/Type de tissu/Technique d’analyse | Durée mesurée |
|---|---|---|
| Animal | ||
| Pfizer (Ministère de la Santé japonais) 2020 [ 46 ] | LNP radiomarqués dans le plasma et les tissus | 140 h – 14 jours |
| Humain | ||
| Ogata et al. (2021) [ 52 ] | Protéine Spike et sous-unité S1 (dosage) | 3 jours |
| Bansal et al. (2021) [ 57 ] | Protéine Spike | 4 mois |
| Fertig et al. (2022) [ 50 ] | LNP et ARNm | 15 jours |
| Röltgen et al. (2022) [ 53 ] | ARNm et protéine Spike dans les ganglions lymphatiques ipsilatéraux ; 2 à 7 jours après l’administration, dans le sang | 60 jours |
| Yamamoto et al. (2022) [ 58 ] | Protéine Spike dans la peau | 3 mois |
| Yonker et al. (2023) [ 54 ] | Protéine Spike dans le sang | 1 à 19 jours en cas de myocardite |
| Castruita et coll. (2023) [ 51 ] | ARNm dans le plasma | 28 jours |
Les cellules qui absorbent l’ARNm des vaccins à ARNm encapsulent une partie de cet ARNm avec des lipides cationiques ionisables dans de petites particules lipidiques libérées sous forme d’exosomes [ 59 ]. D’autres recherches ont montré que les protéines Spike persistent dans les exosomes circulants pendant au moins quatre mois après la vaccination Pfizer contre la COVID-19 [ 57 ]. Ceci indique que la persistance des protéines Spike, à l’instar de celle de l’ARNm, est durable in vivo. La réactivation du virus varicelle-zona (VZV) sous forme de zona est l’effet indésirable cutané le plus fréquent après la vaccination contre la COVID-19 par ARNm, et un cas a été rapporté où la protéine Spike a été détectée dans des lésions cutanées trois mois après la vaccination [ 58 ]. Ces auteurs ont émis l’hypothèse que :
« La vaccination contre la COVID-19 par ARNm pourrait induire une réactivation persistante du VZV en perturbant le système immunitaire, bien qu’il reste difficile de déterminer si la protéine Spike exprimée joue un rôle pathogène ».
[ 58 ] (résumé)
Les auteurs avancent plusieurs hypothèses quant à la manière dont les vaccins contre la COVID-19 pourraient perturber le système immunitaire : via les nanoparticules lipidiques, la N1-méthylpseudouridine présente dans l’ARNm, la protéine Spike (en particulier la sous-unité S1), l’exacerbation de la réponse immunitaire par les anticorps et une stimulation antigénique excessive [ 58 ]. Notre analyse d’une littérature abondante et en constante expansion révèle que ces hypothèses sont fondées et que la protéine Spike joue un rôle pathogène.
6.4. Toxicologie des nanoparticules
En 2018, Wang et al. ont démontré que même de faibles quantités de nanoparticules absorbées par voie pulmonaire ou cutanée peuvent induire des effets cytotoxiques [ 60 ]. Ingérées, les nanoparticules ciblent principalement les ganglions lymphatiques mésentériques, le foie et la rate. Injectées comme vecteurs de médicaments, elles peuvent franchir toute barrière et migrer vers le cerveau, les ovaires et les testicules, principalement après phagocytose par les macrophages qui contribuent à leur distribution dans l’organisme. Les effets toxiques sur la reproduction ne sont pas abordés dans cette revue.
Les mécanismes moléculaires impliqués dans la toxicité des nanoparticules pour le système reproducteur ne sont pas entièrement compris, mais les mécanismes possibles incluent le stress oxydatif, l’apoptose, l’inflammation et la génotoxicité par induction d’espèces réactives de l’oxygène (ROS), provoquant des dommages aux niveaux moléculaire et génétique qui entraînent une cytotoxicité et des dommages à l’ADN.
Les complexes ARNm-LNP sont particulièrement préoccupants en raison de deux excipients fonctionnels propriétaires, ALC-0315 et ALC-0159, jamais utilisés auparavant dans un médicament et non enregistrés dans la Pharmacopée européenne ni dans l’inventaire européen des médicaments et des produits de santé [ 61 ]. Une question posée au Parlement européen en décembre 2021 soulignait qu’« Echelon, le fabricant de ces nanoparticules, précise qu’elles sont « réservées à la recherche et non à l’usage humain » ». La Commission européenne a répondu que l’excipient « a démontré, au sein de Comirnaty, son adéquation… conformément aux lignes directrices et normes scientifiques pertinentes de l’EMA » [ 62 ]. Malgré cette assurance, la présence d’électrolytes dans la préparation et la dilution manuelle avant inoculation soulèvent de sérieuses questions quant à la stabilité de la suspension obtenue et à l’indice de polydispersité des nanomatériaux qu’elle contient, facteurs susceptibles d’être à l’origine de nombreux effets indésirables post-vaccinaux.
Une nanoparticule en solution forme un système colloïdal dont la stabilité empêche l’agrégation des particules par répulsion électrostatique. Le paramètre utilisé pour calculer la stabilité colloïdale est le potentiel zêta, qui correspond au potentiel généré par une double couche de charges électriques. Lorsque le potentiel est faible, les forces d’attraction prédominent sur les forces de répulsion, favorisant ainsi la formation d’agrégats. La stabilité d’un système colloïdal biphasique repose sur un équilibre délicat dépendant des proportions, des méthodes de traitement, des températures adéquates et de la présence d’électrolytes [ 63 ]. Après dilution avec une solution de chlorure de sodium, le rapport final dans la solution de Comirnaty est de 2,61 mg d’électrolytes contre seulement 0,48 mg d’ALC-0315 + ALC-0159. Ceci ne peut qu’entraîner une réduction drastique du potentiel zêta, avec pour conséquences prévisibles l’agrégation, l’agglomération et, finalement, la floculation. On peut donc envisager les dommages causés par l’agrégation de nanoparticules dans les capillaires de l’organisme.
Si la suspension colloïdale reste suffisamment stable pour se disperser dans la lymphe et le sang, les nanoparticules, ainsi que leur charge toxique, se répartiront dans tout l’organisme, traverseront les barrières hémato-encéphalique, hémato-placentaire et autres barrières biologiques, et provoqueront probablement la mort cellulaire et une inflammation là où elles s’accumuleront. De plus, l’élimination des nanoparticules toxiques de l’organisme est complexe. Les particules de 5,5 nm ou moins peuvent être excrétées par les voies urinaires après filtration glomérulaire rénale. Les particules plus grosses pourraient théoriquement être dégradées lors de leur passage dans le système hépatobiliaire ; cependant, elles ont tendance à être liées par des cellules comme les cellules de Kupffer, les macrophages résidents, ce qui ralentit considérablement leur traitement [ 64 ]. Les complexes ARNm-LNP mesurent environ 100 nm, une taille bien supérieure à celle permettant leur élimination par les reins. Ceci expliquerait leur accumulation dans le foie et la toxicité hépatique observée.
6.5. Les nanoparticules lipidiques sont pro-inflammatoires
Il a été constaté que les nanoparticules lipidiques utilisées dans les vaccins contre la COVID-19 induisent une sécrétion importante de cytokines inflammatoires et de protéines inflammatoires des macrophages, associée à la mort cellulaire [ 43 ]. Ndeupen et al. [ 43 ] soulignent que cet effet pro-inflammatoire des nanoparticules lipidiques augmenterait l’immunogénicité de l’adjuvant vaccinal des vaccins à ARNm contre la COVID-19 et aggraverait les effets indésirables. Les auteurs n’ont pas pris en compte la large biodistribution des nanoparticules lipidiques et, par conséquent, le risque d’effets indésirables graves et étendus des vaccins contre la COVID-19, touchant divers organes et systèmes.
Trougakis et al. [ 65 ], dans leur analyse de la littérature sur les effets indésirables des vaccins à ARNm contre la COVID-19, ont souligné le risque de pathologies induites par la protéine Spike, qu’ils ont nommées « hypothèse Spike ». Cependant, Trougakis et ses collègues ont également examiné les données probantes relatives aux propriétés pro-inflammatoires des nanoparticules lipidiques issues d’études sur des modèles animaux. Ces propriétés incluent « l’activation des récepteurs Toll-like, une infiltration excessive de neutrophiles, l’activation de diverses voies inflammatoires et la production de diverses cytokines et chimiokines inflammatoires » [ 65 ] (p. 544).
Par conséquent, même en modifiant l’antigène exprimé, des effets indésirables sont probables. Halma et al. [ 66 ] soulignent que les modifications apportées à l’ARNm et à la composition des nanoparticules lipidiques, notamment l’ajout de polyéthylène glycol (PEG), ont accru leur résistance à la dégradation et facilité leur échappement au système immunitaire. Les nanoparticules lipidiques favorisent la biodistribution et la bioaccumulation. La bioaccumulation peut entraîner l’obstruction des petits vaisseaux sanguins et lymphatiques. La biodistribution peut provoquer la mort cellulaire et une inflammation dans tous les organes, y compris le cerveau, le placenta et les testicules, comme cela a été observé avec le vaccin à ARNm contre la COVID-19 [ 5 , 44 , 45 , 46 ].
Il est connu que le PEG peut provoquer des réactions anaphylactiques chez certaines personnes ; cet effet indésirable est mentionné dans la notice d’information destinée aux patients. Outre le fait que l’ARNm encapsulé dans des nanoparticules lipidiques est fortement inflammatoire, les anticorps dirigés contre la protéine Spike endommagent les cellules et les tissus qui produisent cette protéine. Quel que soit l’antigène produit, des lésions cellulaires se produiront lors d’une réaction auto-immune [ 67 ].
Les mécanismes impliqués dans les lésions auto-immunes des cellules produisant une protéine endogène comprennent le développement d’une réactivité croisée à cette protéine [ 68 ], une toxicité à médiation immunitaire [ 69 ] et une tolérance immunitaire due au passage à une réponse immunitaire de type IgG4 [ 70 ]. Ce passage à une réponse immunitaire de type IgG4 a des conséquences sur la susceptibilité au cancer [ 71 ], la grossesse [ 72 ] et les maladies liées aux IgG4, qui sont des affections inflammatoires chroniques [ 73 ].
Un autre risque, problématique avec les vaccins précédents contre les coronavirus dans le domaine humain et vétérinaire, est le risque d’amélioration dépendante des anticorps [ 66 ].
6.6. Toxicité du vaccin Novavax contre la COVID-19 et nouvelle technologie lipidique-nanoparticulaire
Le rôle important de la biodistribution des nanoparticules lipidiques dans la survenue d’effets indésirables est également suggéré par les rapports d’effets indésirables du vaccin protéique contre la COVID-19 Nuvaxovid de Novavax. Ce vaccin utilise une technologie innovante de matrice de nanoparticules lipidiques susceptible d’améliorer la biodistribution de la protéine Spike non modifiée, avec des sites de clivage par la furine et des domaines de liaison aux récepteurs intacts. Interrogée sur les études de biodistribution, Novavax a indiqué mi-2021 qu’« aucune étude pharmacocinétique/pharmacodynamique n’a été réalisée sur le vaccin Novavax contre la COVID-19 » (communication personnelle Novavax-Parry, 30 juillet 2021).
Des cas de myocardite ont été rapportés suite à l’administration du vaccin Novavax contre la COVID-19 dans plusieurs pays, dont la Nouvelle-Zélande, où l’autorité de réglementation a publié une alerte concernant ce risque [ 74 ]. Ceci suggère qu’une quantité pathogène de protéines Spike du vaccin Novavax peut occasionnellement atteindre le cœur. Globalement, le nombre de cas d’effets indésirables rapportés avec le vaccin Novavax contre la COVID-19 est inférieur à celui observé avec les vaccins à thérapie génique, ce qui serait cohérent avec un effet dose-réponse des protéines Spike. Cependant, la matrice lipidique-nanoparticulaire elle-même pourrait être responsable de certains cas de myocardite.
6.7. Données de biodistribution du vaccin COVID-19 d’AstraZeneca
En octobre 2022, une demande d’accès à l’information (MHRA IR07151D) a permis d’obtenir des documents d’AstraZeneca soumis à la MHRA britannique. Selon le document « Aperçu non clinique » d’AstraZeneca daté du 21 décembre 2020, la justification de l’absence initiale d’études de biodistribution sur le vaccin à ADN adénoviral contre la COVID-19 d’AstraZeneca reposait sur le fait que des études antérieures sur les vaccins à vecteur viral avaient montré une diffusion minimale du muscle deltoïde et des ganglions lymphatiques axillaires vers les organes distaux [ 75 ].
« La biodistribution de l’AZD1222 après administration intramusculaire devrait être similaire à celle de l’AdCh63, limitée au site d’injection et aux ganglions lymphatiques de drainage . »
[ 75 ] (p. 13)
Toutefois, un « aperçu non clinique » ultérieur d’AstraZeneca daté du 26 avril 2021, qui comprenait de nouvelles études de biodistribution chez la souris sur le vaccin COVID-19 de la société, a révélé une biodistribution vers des organes distaux [ 6 ] :
Les concentrations les plus élevées d’ADN du vecteur AZD1222 (10³ à 10⁷ copies/µg d’ADN) ont été observées au niveau des sites d’administration intramusculaire et du nerf sciatique (à proximité immédiate des sites d’administration) le deuxième jour. Des concentrations plus faibles d’ADN du vecteur AZD1222 (inférieures à la limite inférieure de quantification à 10⁶) ont été observées. 4 Des copies/μg d’ADN) ont été observées dans la moelle osseuse, le foie, la rate et les poumons au jour 2. Les niveaux d’AZD1222 et le nombre de tissus présentant des niveaux détectables d’ADN du vecteur AZD1222 ont diminué du jour 2 au jour 29, indiquant une élimination .
[ 6 ] (p. 14)
Le document soulignait que le vecteur viral lui-même ne se répliquait pas comme un adénovirus, mais cela ne tient pas compte de la production de protéines d’un antigène étranger toxique dans les organes. Bien que cela suggère une biodistribution moindre des vaccins anti-COVID-19 à ADN vecteur viral que des vaccins anti-COVID-19 à ARNm modifié véhiculés par des nanoparticules lipidiques, la capacité des vaccins à ADN vecteur adénoviral à produire des quantités importantes de protéines Spike demeure. Une série d’autopsies de trois cas de thrombocytopénie thrombotique immunologique (TTI) avec thrombose cérébrale induite par le vaccin AstraZeneca contre la COVID-19 a révélé la présence de protéines Spike dans les thromboses et les parois des veines cérébrales [ 7 ]. Les auteurs indiquent dans le résumé :
« La protéine Spike du SARS-CoV-2 a été détectée au sein du thrombus et dans la paroi vasculaire adjacente. Les données indiquent que les neutrophiles et l’activation du complément associés à l’immunité anti-Spike déclenchée par le vaccin sont probablement impliqués dans le processus pathologique . »
6.8. Les vaccins traditionnels contre la COVID-19 ne sont pas à l’origine d’un nombre élevé de rapports d’effets indésirables.
Les vaccins traditionnels contre la COVID-19 sont principalement disponibles dans les pays non occidentaux [ 35 ]. Il s’agit notamment de vaccins à virus inactivé comme le Covaxin, fabriqué par Bharat Biotech [ 76 ] en Inde, et le CoronaVac, fabriqué par Sinovac [ 77 ] en Chine.
Il existe également des vaccins traditionnels contre la COVID-19 à base de protéines recombinantes, tels que Spikogen, développé conjointement par des entreprises australiennes et iraniennes [ 78 , 79 , 80 ]. Dans Spikogen, l’antigène de la protéine Spike a été modifié par suppression du site de clivage de la furine et du RBD afin de réduire l’adhérence et la pénétration cellulaires, et ainsi diminuer la toxicité potentielle. Un essai clinique de phase 3 de Spikogen mené en Iran auprès de 16 876 participants a atteint son critère d’efficacité principal, avec une protection supérieure à 60 % contre l’infection lors d’une vague particulièrement importante du variant delta du SARS-CoV-2 en Iran [ 81 , 82 ]. Spikogen est commercialisé en Iran et autorisé pour les voyages dans certains pays, dont la Nouvelle-Zélande. À ce jour, 8 millions de doses ont été administrées sans qu’aucun effet indésirable systémique grave n’ait été signalé aux autorités de pharmacovigilance iraniennes.
Les vaccins traditionnels contre la COVID-19 n’ont pas entraîné les taux élevés de signalements d’effets indésirables qui caractérisent les vaccins à thérapie génique. Ceci confirme que le risque réside dans la biodistribution à l’échelle de l’organisme et la production prolongée de la protéine Spike. Cela met en évidence la pathogénicité de cette protéine et, compte tenu des éléments décrits précédemment, également celle de la matrice lipidique-nanoparticulaire.
6.9. Risque auto-immun lié aux antigènes étrangers présentés par les propres cellules de l’organisme
Comme décrit précédemment, il est établi que la protéine Spike est intrinsèquement toxique. Même si elle était non toxique en soi, son caractère étranger pourrait lui permettre d’induire des lésions physiopathologiques par le biais de réponses auto-immunes, une conséquence directe de la présence d’une protéine étrangère. La matrice lipidique de nanoparticules permet une large biodistribution des ARNm codant pour les gènes dans la plupart, voire la totalité, des organes. L’expression subséquente de la protéine Spike à la surface des cellules, ainsi que sous forme de protéine soluble dans les organes et la circulation sanguine, induit la destruction des cellules et des tissus par les lymphocytes T et la production d’anticorps par les lymphocytes B. Ces derniers peuvent également entraîner le dépôt de complexes immuns, endommageant davantage les tissus par hypersensibilité de type III.
Les lésions tissulaires peuvent donc être provoquées par la protéine Spike via des réactions auto-immunes, même si elle est considérée comme « non toxique ». Si cela a des conséquences mineures dans un muscle comme le deltoïde, cela peut entraîner des effets indésirables graves, voire mortels, lorsqu’elle se produit dans des organes vitaux tels que le cerveau, les ovaires et le cœur. Le mode d’administration – la thérapie génique par ARNm via des nanoparticules lipidiques traversant les membranes biologiques – constitue un problème majeur et explique en grande partie pourquoi cette technologie n’a jamais été commercialisée jusqu’à présent.
Le fait que Moderna et d’autres grandes entreprises pharmaceutiques prévoient une production à grande échelle de vaccins à ARNm pour de nombreuses autres maladies, en l’absence d’une enquête complète et détaillée, est donc profondément inquiétant.
6.10. Physiopathologie de la protéine Spike virale et vaccinale
L’évolution naturelle des nouveaux virus pandémiques/épidémiques est de devenir plus infectieux et moins pathogènes avec le temps. Cela a été clairement observé avec le SARS-CoV-2 : la souche originale de Wuhan, ainsi que les variants alpha et autres variants précoces ultérieurs, étaient très pathogènes ; le variant delta s’est propagé plus facilement mais était légèrement moins pathogène ; et les différents sous-variants omicron étaient très infectieux mais encore moins pathogènes en termes de gravité de la maladie. En particulier, les sous-variants omicron ont ciblé les voies respiratoires supérieures plutôt que les voies respiratoires inférieures, ce qui a entraîné une moindre pénétration systémique du virus et de la protéine Spike [ 83 ].
En revanche, les vaccins à ARNm et à ADN adénoviral induisent dans les cellules humaines la production d’une version légèrement modifiée de la protéine Spike de la souche originale de Wuhan. Certaines doses de rappel « bivalentes » ajoutent le code génétique de la protéine Spike variante Omicron [ 84 , 85 ]. Si ce code génétique est largement diffusé chez un individu, la quantité de protéines Spike produites dans son système immunitaire peut être bien supérieure à celle généralement observée avec le virus naturel. Ce risque est plus élevé chez les personnes jeunes et en bonne santé. Les personnes âgées et celles présentant des comorbidités sont plus à risque de développer une infection grave au SARS-CoV-2, touchant profondément les poumons et se propageant dans tout le système respiratoire, tandis que les personnes jeunes et en bonne santé ont tendance à éliminer le virus au niveau des muqueuses des voies respiratoires supérieures. Par conséquent, chez les personnes jeunes et en bonne santé, les vaccins contre la COVID-19 à base de gènes codants transfecteront un ensemble de tissus beaucoup plus diversifié que le virus lui-même.
De nombreuses études ont démontré la toxicité de la protéine Spike. Dans leur article intitulé « Comprendre la pharmacologie des vaccins à ARNm contre la COVID-19 : jouer avec le feu avec la protéine Spike ? », Cosentino et Marino (2022) ont passé en revue les données probantes relatives à la toxicité de cette protéine [ 86 ]. Ils ont soutenu que les vaccins à ARNm contre la COVID-19 devraient être qualifiés de « promédicaments », car ils correspondent à la définition du dictionnaire : « une substance pharmacologiquement inactive qui est transformée dans l’organisme (par exemple, par action enzymatique) en un médicament pharmacologiquement actif ». Ce processus se déroule grâce à l’action de l’ARNm dans les ribosomes, qui induit la synthèse de la protéine Spike [ 86 ] (p. 3).
Cosentino et Marino (2022) ont examiné les preuves de la biodistribution généralisée de l’ARNm et ont conclu que « les preuves soutiennent fortement le lien possible entre l’expression inappropriée de la protéine S dans les tissus sensibles et les dommages tissulaires ultérieurs » [ 86 ] (p. 2).
Ils ont passé en revue la littérature sur la pharmacologie et les effets physiopathologiques de la protéine Spike sur les tissus corporels, notamment [ 86 ] (p. 4–5) :
- La liaison aux récepteurs ACE-2 constitue un « déclencheur potentiel de l’agrégation plaquettaire, de la thrombose et de l’inflammation, ainsi que de l’hypertension et d’autres maladies cardiovasculaires ».
- La perturbation de la glycoprotéine transmembranaire CD147, qui interfère avec la fonction des péricytes cardiaques et des érythrocytes, peut entraîner une myocardite, une anémie hémolytique, une hyperviscosité sanguine et éventuellement des processus neurodégénératifs.
- La liaison aux récepteurs Toll-like 2 et 4 (TLR2, TLR4), avec des effets pathogènes théoriques via l’augmentation des cascades de cytokines inflammatoires, en raison (1) de l’activation du facteur nucléaire kappa B (voie NF-κB) et d’une fonction immunitaire déficiente des macrophages via TLR2, et (2) des lésions pulmonaires, une myocardite et des lésions multiorganiques via TLR4, qui n’avaient pas encore été correctement étudiées par la communauté de recherche mondiale.
- La liaison au récepteur alpha des œstrogènes à haute affinité (ER alpha) est possiblement responsable des irrégularités menstruelles fréquemment observées après la vaccination contre la COVID-19 et soulève des inquiétudes quant à une implication potentielle dans le cancer du sein.
- La sous-unité S2 de la protéine Spike interagit spécifiquement avec les protéines p53 BP1 et BRCA1. La p53 BP1 est un suppresseur de tumeur bien établi ; la BRCA1 est fréquemment mutée à la fois dans le cancer du sein et dans le cancer de la prostate [ 87 ].
Cosentino et Marino ont noté que ces « problèmes toxicologiques potentiels » n’avaient pas été « pris en compte dans les études qui ont conduit à l’autorisation de mise sur le marché, précisément parce que… ces produits ont été traités comme des vaccins conventionnels », alors qu’il s’agit en fait d’insertions de gènes agissant comme des promédicaments [ 86 ] (p. 5).
Des recherches in vitro ont montré que le domaine de liaison au récepteur (RBD) de la protéine Spike (l’unité S1) était l’agent le plus actif pour déclencher une réponse pro-inflammatoire des cellules dendritiques [ 88 ].
Des recherches in vitro complémentaires menées sur des cellules musculaires et endothéliales de l’artère pulmonaire humaine traitées soit avec la protéine Spike entière, soit avec le seul domaine de liaison au récepteur (RBD), ont montré que le RBD était relativement inerte, tandis que la protéine Spike entière induisait une hypertrophie des cellules vasculaires pulmonaires par phosphorylation de la protéine MEK (mitogen-activated protein kinase kinase) [ 89 ]. Ce phénomène a également été observé in vivo : l’administration intratrachéale du complexe S1/RBD à des souris transgéniques exprimant l’ACE2 humain a entraîné une augmentation importante des cytokines inflammatoires dans le liquide de lavage broncho-alvéolaire des souris ayant reçu le complexe S1 de la protéine Spike. Cette augmentation était minime chez les souris témoins (solution saline intratrachéale) et légère et tardive chez les souris ayant reçu la protéine Spike entière, indiquant que le clivage du complexe S1 (RBD) aggrave la pathologie associée à l’ACE2 [ 90 ].
L’injection de protéines Spike S1/RBD à des souris génétiquement modifiées pour exprimer des récepteurs ACE2 similaires à ceux de l’homme a induit une pathologie pulmonaire aiguë semblable à celle de la COVID-19, indiquant que c’est la protéine Spike, à moins d’être modifiée comme dans le vaccin australo-iranien Spikogen [ 78 , 79 ], qui constitue la cytotoxine principalement responsable de la gravité de l’infection respiratoire par le SARS-CoV-2 [ 86 ]. Rétrospectivement, cela signifie qu’elle s’est avérée un choix particulièrement malheureux pour le développement de vaccins.
Dans une prépublication, McKernan et al. [ 91 ] quantifient la pharmacocinétique des vaccins à ARNm comme créant un plus grand nombre de protéines de pointe que le virus SARS-CoV-2, et de manière plus systémique chez la plupart des personnes non sujettes à une infection virale COVID-19 accablante :
« La pharmacocinétique de l’injection diffère de celle d’une infection ; 30 à 100 µg d’ARNm de la protéine Spike par injection (90 à 300 µg pour les rappels) correspondent à 13 à 40 milliards de molécules d’ARNm injectées en quelques secondes à chaque injection. La pharmacocinétique de cette injection en bolus diffère de celle de la réplication virale qui se déroule sur plusieurs jours. Si chacun de ces ARNm peut produire 10 à 100 protéines Spike et que l’on compte 30 à 40 milliards de cellules, la quantité systémique de protéines Spike pourrait être bien plus importante et la durée d’exposition bien plus longue par voie vaccinale que lors d’une infection naturelle . »
[ 91 ] (p.12)
La production d’antigènes par les tissus humains implique que la dose est susceptible de varier d’un individu à l’autre. Cette variabilité est due à des facteurs génétiques et physiologiques individuels, aux tissus exposés, à la variabilité du lot et du flacon du produit, ainsi qu’aux conditions de transport, de réfrigération et d’administration. Au regard du principe toxicologique « c’est la dose qui fait le poison », cet aspect à lui seul soulève des doutes quant à la sécurité des vaccins à ARNm et à ADN à vecteur viral.
Au moment même où les vaccins contre la COVID-19 étaient mis à la disposition du public, des chercheurs du Salk Institute ont découvert que le virus SARS-CoV-2 utilise la protéine Spike pour se lier aux récepteurs ACE2 des cellules hôtes afin d’y pénétrer [ 92 ]. L’ACE2 joue un rôle protecteur dans le système cardiovasculaire, et la protéine Spike du SARS-CoV-2 favorise les lésions pulmonaires en diminuant le taux d’ACE2. L’équipe du Salk Institute a démontré que la protéine Spike, à elle seule, peut endommager les cellules endothéliales vasculaires par la régulation négative de l’ACE2, l’inhibition de la synthase d’oxyde nitrique endothéliale (eNOS), l’altération de la fonction mitochondriale et l’altération directe de la fonction endothéliale.
6.11. Perturbation de la voie anti-inflammatoire nicotinique cholinergique
De fortes doses du domaine de liaison à la protéine Spike (RBD), de type toxine, inhibent les réponses des récepteurs nicotiniques α7 (α7 nAChR) induites par l’acétylcholine (ACh). L’inhibition de ces récepteurs α7 nAChR a des effets importants [ 33 ]. Le système cholinergique nicotinique est appelé « voie anti-inflammatoire cholinergique » (CAP), car l’activation de ces récepteurs contrôle l’inflammation et leur inhibition entraîne une inflammation incontrôlée. La CAP forme un réseau complexe, présent dans les cellules neuronales et non neuronales, et remplit diverses fonctions dans tout l’organisme. Outre le système nerveux, les récepteurs α7 nAChR sont exprimés dans des cellules non neuronales telles que les lymphocytes, les monocytes, les macrophages, les cellules dendritiques, les adipocytes, les kératinocytes, les cellules endothéliales et les cellules épithéliales de l’intestin et du poumon. Avec une distribution aussi répandue, les nAChR pourraient être impliqués dans la physiopathologie du COVID-19 sévère via des mécanismes, à la fois par et indépendamment de la voie anti-inflammatoire cholinergique [ 32 ].
La modulation de la réponse inflammatoire et immunitaire par le SNC via le nerf vague repose sur une communication bidirectionnelle entre les systèmes immunitaire et nerveux. Les fibres afférentes du nerf vague, situées dans le noyau du tractus solitaire, transmettent au SNC des informations sensorielles sur l’état inflammatoire, ce qui peut entraîner la transmission de signaux efférents, provenant du noyau moteur dorsal, afin de contrôler la réponse inflammatoire. Cette réponse est rapide et localisée, contrairement au réseau anti-inflammatoire diffus, qui est lent, distribué, non intégré et dépendant des gradients de concentration [ 32 ].
Activés par la libération d’acétylcholine (ACh) via le nerf vague, les récepteurs nicotiniques de l’acétylcholine (nAChR) sont présents dans le système immunitaire, notamment sur les lymphocytes T, les lymphocytes B, les macrophages, les monocytes, les neutrophiles et les mastocytes. Ils contribuent à réduire l’inflammation, en diminuant la production de cytokines pro-inflammatoires telles que l’IL-6, tout en stimulant celle de cytokines anti-inflammatoires comme l’IL-4 [ 93 ]. Un dérèglement des nAChR induit par le SARS-CoV-2 pourrait également supprimer l’équilibre du système nerveux sympathique et ainsi favoriser l’activation du système sympathique central et le développement d’une tempête cytokinique d’origine sympathique [ 94 ]. Cette tempête sympathique induit à son tour un stress oxydatif et une hyperinflammation en augmentant la production d’espèces réactives de l’oxygène (ROS) et la libération de cytokines pro-inflammatoires.
Les récepteurs nicotiniques de l’acétylcholine (NAChR) sont également présents dans les voies respiratoires. Les récepteurs α3β4 nAChR sont impliqués dans la fonction ciliaire et la clairance mucociliaire, tandis que la stimulation des récepteurs α7 nAChR a un effet anti-inflammatoire. Par conséquent, l’inhibition de ces deux types de récepteurs, comme c’est le cas pour la protéine Spike, contribuerait significativement à la pathologie pulmonaire observée dans la forme aiguë et la forme longue de la COVID-19 [ 95 ].
L’infection par le SARS-CoV-2 induit un stress et une suppression des voies cholinergiques via l’inhibition des récepteurs nicotiniques de l’acétylcholine (nAChR) qui peuvent également activer le système nerveux sympathique (SNS), entraînant une stimulation neuro-hormonale et l’activation de cytokines pro-inflammatoires, avec pour conséquence le développement d’une tempête sympathique. L’hyperactivation sympathique observée dans la COVID-19 est corrélée à une augmentation de la perméabilité capillaire pulmonaire, à des lésions alvéolaires et au développement d’un syndrome de détresse respiratoire aiguë. De plus, le SARS-CoV-2 peut se propager de manière rétrograde, via les mécanorécepteurs et les chémorécepteurs pulmonaires, jusqu’au centre respiratoire bulbaire, provoquant une insuffisance respiratoire aiguë par inhibition des nAChR dans les centres bulbaires parasympathiques [ 96 ].
Une fois infectée par le SARS-CoV-2, une personne active son système immunitaire. Lors de la réplication virale, les débris cellulaires et viraux, ou virions, peuvent interagir avec les récepteurs nicotiniques de l’acétylcholine (nAChR) et bloquer la voie anti-inflammatoire cholinergique. Si la réponse immunitaire initiale est insuffisante pour combattre l’invasion virale à un stade précoce, la réplication virale importante et prolongée finit par perturber cette voie et compromet gravement la capacité à contrôler et réguler la réponse immunitaire. L’action incontrôlée des cytokines pro-inflammatoires entraîne un orage cytokinique, avec lésions pulmonaires aiguës, syndrome de détresse respiratoire aiguë (SDRA), troubles de la coagulation et défaillance multiviscérale. Selon cette hypothèse, la COVID-19 semble devenir une maladie du système cholinergique nicotinique [ 92 ].
Ce même mécanisme peut expliquer à la fois l’étendue et la gravité des symptômes observés dans le COVID long et les effets indésirables liés à la vaccination contre la COVID-19. Le premier se caractérise par une incapacité à éliminer la protéine Spike et le virus, entraînant une activation immunitaire incontrôlée et des séquelles [97], Dans le second cas, la protéine Spike, produite en excès pendant des mois, sature le système immunitaire, et la charge virale augmente à chaque injection. Ce mécanisme ouvre également la voie à d’éventuelles interventions par des agonistes des récepteurs nicotiniques α7 (α7 nAChR) et des modulateurs allostériques positifs (PAMS).
7. Preuves de « spikeopathie » — Pathogénicité de la protéine Spike
La protéine Spike du SARS-CoV-2 s’est révélée pathogène. Le terme « spikopathie » a été créé [98] car ses effets pathologiques, à l’instar de la tuberculose, semblent nombreux, disséminés dans l’organisme et induisent une multitude de maladies et de syndromes connus. On trouve également l’orthographe « spikeopathy » sur Internet, et nous avons opté pour cette graphie.
La figure 6 montre que la FDA était consciente de ce risque potentiel avant la mise sur le marché des vaccins contre la COVID-19 à base de gènes. Il s’agit de la 16e diapositive d’une présentation PowerPoint de la réunion du « Comité consultatif sur les vaccins et les produits biologiques apparentés (VRBPAC), le 22 octobre 2020 » [ 99 ]. Ce qui est frappant, c’est la précision prédictive de ces « effets indésirables possibles », principalement neurologiques, cardiovasculaires et auto-immuns, par rapport à ceux signalés au VAERS et à d’autres bases de données mondiales sur les effets indésirables des vaccins.

Le site web www.react19.org recense, en juin 2023, plus de 3 400 articles et rapports de cas publiés sur les effets indésirables des vaccins contre la COVID-19, classés par système d’organes et syndrome [ 100 ]. Nous examinerons ici certains systèmes d’organes clés en lien avec les effets pathogènes de l’ARNm du SARS-CoV-2 et des protéines de spicule produites par l’ADN adénoviral.
7.1. Pathogénie cardiovasculaire
La littérature s’accumule sur les dommages cardiovasculaires des vaccins contre la COVID-19. Par exemple, en juin 2023, react19.org, sous la rubrique « Cardiaque », répertorie 432 articles évalués par des pairs et rapports de cas couvrant la myocardite, la cardiomyopathie, l’infarctus du myocarde, l’hypertension, la dissection aortique, le syndrome de tachycardie orthostatique posturale (STOP), la tachycardie et les troubles de la conduction [ 100 ].
7.1.1. Myocardite et péricardite
Les cas de myocardite et de péricardite sont particulièrement nombreux. Yonker et al. [ 54 ] ont détecté des protéines Spike libres dans le sang de 16 adolescents et jeunes adultes ayant développé une myocardite post-vaccinale, contrairement à 45 sujets témoins appariés en âge et n’ayant pas développé de myocardite. Les auteurs ont examiné les profils immunologiques et les concentrations plasmatiques de protéines Spike libres chez de jeunes sujets atteints de myocardite après vaccination par des vaccins à ARNm contre la COVID-19. Des concentrations significativement plus élevées de protéines Spike libres entières, non liées aux anticorps, ont été observées chez les patients atteints de myocardite, comparativement aux témoins. Les profils d’anticorps et les réponses des lymphocytes T étaient similaires entre les sujets atteints de myocardite et les témoins soigneusement appariés en âge. Cependant, une partie de la variance observée concernant la myocardite en tant que complication de la vaccination à ARNm pourrait s’expliquer par une transcription et une sécrétion sanguine plus importantes chez certains sujets. Ceci soulève de sérieuses inquiétudes quant à la pathogénicité des protéines Spike libres dans ces cas de myocardite.
Avolio et al. [ 101 ] ont découvert que la protéine Spike du SARS-CoV-2, libérée et séparée du virus, pouvait induire une atteinte microvasculaire par plusieurs mécanismes, notamment la stimulation des péricytes cardiaques et la production de cytokines pro-inflammatoires via la liaison au récepteur CD147. D’autres études chez la souris apportent des preuves supplémentaires de la pathogénicité de la protéine Spike : la fibrose cardiaque et l’altération de la contractilité myocardique induites par cette protéine pourraient être à l’origine de la cardiomyopathie associée à la COVID-19 [ 102 ].
L’hypothèse selon laquelle la myocardite associée au vaccin contre la COVID-19, contrairement à la myocardite d’hypersensibilité observée avec des agents tels que le vaccin antivariolique, serait en réalité auto-immune, est envisagée par Baumeier et ses collègues [ 103 ] dans une série de 15 cas ayant fait l’objet de biopsies endomyocardiques (BEM), étude qui sera abordée plus loin dans cet article. À l’instar d’autres études et observations cliniques, une infiltration lymphocytaire a été observée en association avec l’expression de spicules intracardiaques (bien que les auteurs n’aient pas spécifiquement mentionné les caractéristiques de biodistribution des nanoparticules lipidiques).
Dans une étude récente menée à Yale, Barmada et al. [ 104 ], à la lumière des résultats de Yonker et al. [ 54 ] et de Baumeier et al. [ 103 ], examinent si le mimétisme moléculaire induit par la protéine Spike est à l’origine de l’attaque myocardique auto-immune. Ils excluent cette possibilité grâce à une étude sérique utilisant le test REAP, un « profilage rapide des antigènes extracellulaires » pour la recherche d’auto-anticorps. Ils postulent également une « cytokinopathie », en se référant aux profils de cytokines sériques et à d’autres marqueurs d’inflammation dans un sous-groupe, mais ne rapportent pas les concentrations sanguines de la protéine Spike ni n’obtiennent de tissu myocardique.
Bien que de nombreuses études en laboratoire restent à mener concernant l’inflammation myocardique observée après les vaccinations à ARNm, il semble que la protéine Spike joue un rôle. Si le mimétisme moléculaire n’en est pas la cause, des effets toxiques directs de la protéine Spike pourraient être impliqués, en plus de la réaction du système immunitaire à sa présence, qu’elle soit exprimée ou déposée dans le myocarde. Le fait que la myocardite soit déclenchée par une « spikeopathie » est également suggéré par le fait que les vaccins anti-COVID-19 à ADN adénovecteur d’AstraZeneca et de Johnson & Johnson, ainsi que le vaccin Novavax à base de protéines et encapsulé dans des nanoparticules lipidiques, ont été rapportés comme étant à l’origine de la maladie [ 105 , 106 ].
Quelle est la fréquence des myocardites et péricardites induites par le vaccin contre la COVID-19 ? À titre de référence, une étude publiée le 7 janvier 2020, à la veille de la pandémie de SARS-CoV-2, a rapporté : « la myocardite virale a un taux d’incidence de 10 à 22 pour 100 000 personnes [ 107 ].
En ce qui concerne l’incidence épidémiologique communautaire, une étude publiée dans le New England Journal of Medicine [ 108 ] a noté que le taux d’incidence annuel dépendait du niveau d’investigation :
Avant la pandémie de COVID-19, l’incidence mondiale estimée de la myocardite était de 1 à 10 cas pour 100 000 personnes par an (12). Le risque le plus élevé concernait les personnes âgées de 20 à 40 ans et les hommes : 6,1 cas pour 100 000 hommes et 4,4 cas pour 100 000 femmes. L’utilisation accrue de l’IRM cardiaque a entraîné une augmentation progressive de l’incidence déclarée de la myocardite aux États-Unis, passant de 9,5 à 14,4 cas pour 100 000 .
[ 108 ] (p. 1488)
Les autorités sanitaires, telles que la FDA, la TGA et d’autres organismes de réglementation, ont affirmé que la myocardite post-vaccinale contre la COVID-19 est très rare. Une étude préliminaire menée auprès de 2,39 millions d’adultes californiens assurés par Kaiser Permanente et ayant reçu au moins une dose d’un vaccin Pfizer ou Moderna contre la COVID-19 n’a recensé que 15 cas de myocardite post-vaccinale, tous des hommes d’un âge moyen de 25 ans [ 109 ]. Toutefois, ces cas étaient basés sur les déclarations des médecins au comité de vaccination de Kaiser Permanente ou sur les hospitalisations survenues dans les 10 jours suivant la vaccination. Des cas plus bénins ont pu passer inaperçus ; les médecins n’ont peut-être pas toujours signalé les cas au comité.
Une revue systématique des déclarations de pharmacovigilance enregistrées dans les bases de données américaines VAERS, britanniques Yellow Card et européennes EudraVigilance jusqu’au 16 mars 2022 a recensé 18 204 cas de myocardite et/ou de péricardite, dont certains mortels [ 110 ]. Compte tenu des centaines de millions de personnes vaccinées, les auteurs ont souligné la rareté de cet événement.
La FDA a reconnu que le risque de myocardite et de péricardite associé aux vaccins à ARNm contre la COVID-19 était réel, notamment chez les jeunes hommes après la deuxième dose, mais a estimé qu’il restait rare. Elle a cité un chiffre issu du VAERS, soit 6,5 cas pour 100 000 et jusqu’à 20 cas pour 100 000 chez les adolescents [ 111 ]. La FDA n’a pas tenu compte du fait que les bases de données de pharmacovigilance, telles que son propre système FAERS (FDA Adverse Event Report System) et le VAERS des CDC, présentent un important sous-déclaration.
Un point commun à cette estimation de la FDA, basée sur les données de pharmacovigilance, et à celles d’autres organismes, est l’omission de mentionner le problème récurrent de la sous-déclaration dans les systèmes de notification passive. Il est reconnu que les bases de données de pharmacovigilance, telles que la FAERS de la FDA et la VAERS des CDC, présentent d’importants taux de sous-déclaration. L’ampleur de cette sous-déclaration fait toutefois débat.
Le phénomène de sous-déclaration des myocardites est aggravé par la difficulté du diagnostic, souvent tributaire de la disponibilité de services spécialisés, d’IRM cardiaques et/ou de biopsies endomyocardiques (BEM). Le diagnostic peut mimer un infarctus du myocarde et conduire à des erreurs. À cet égard, l’article de Baumeier et al. [ 103 ] (abordé plus loin) a montré qu’un tiers des patients présentant une myocardite confirmée histologiquement, classée comme associée à la vaccination sur la base de leurs antécédents et de l’exclusion d’autres causes, ne présentaient pas de signes de myocardite à l’IRM cardiaque. De plus, de nombreux cas de myocardite sont infracliniques et peuvent passer inaperçus en phase aiguë. Cela ne signifie toutefois pas qu’une évolution bénigne est toujours attendue, car même une fibrose et une cicatrisation mineures du myocarde peuvent créer des foyers arythmogènes et se manifester ultérieurement par des arythmies graves et mortelles, ou encore conduire à une insuffisance cardiaque (ce que l’on appelle la cardiomyopathie inflammatoire) [ 112 ]. Il est donc rationnel d’affirmer que la fréquence exacte de la myocardite associée à la vaccination est inconnue : les cas peuvent être subcliniques, manqués ou mal classés et même l’imagerie spécialisée peut sous-diagnostiquer.
Une étude prospective menée en Thaïlande apporte des indications sur la fréquence potentielle des myocardites infracliniques, ou du moins des atteintes myocardiques. Trois cent un adolescents sans antécédents cardiaques ont bénéficié d’un dosage des biomarqueurs cardiaques (troponine T, créatine kinase-MB), d’un électrocardiogramme (ECG), d’une échocardiographie et d’un journal des symptômes cardiaques, à l’inclusion et aux jours 3, 7 et 14 après la deuxième dose du vaccin Pfizer contre la COVID-19 à ARNm [ 113 ]. Bien qu’il n’y ait pas eu de groupe témoin, les résultats du journal, de l’examen clinique et de l’ECG sont préoccupants : « tachycardie (7,64 %), dyspnée (6,64 %), palpitations (4,32 %) et hypertension (3,99 %) » (p. 4). Cinquante-quatre adolescents (18 %) présentaient des anomalies à l’ECG. Une élévation de la troponine a été observée chez cinq adolescents, l’échocardiographie a révélé un épanchement péricardique chez trois d’entre eux, et des signes de myopéricardite chez un adolescent ont nécessité son admission en soins intensifs. Au total, sept adolescents ont présenté « une myopéricardite, une myocardite infraclinique et une péricardite après la deuxième dose de vaccination », mais à l’exception de l’adolescent hospitalisé en soins intensifs, les six autres cas étaient infracliniques ou bénins et auraient facilement pu passer inaperçus sans cette étude prospective rigoureuse [ 113 ] (p. 8, Tableau 3).
Bien que cette étude thaïlandaise, d’une méthodologie rigoureuse, ne semble pas avoir fait l’objet d’une publication complète, un résumé de conférence suggère des résultats comparables, obtenus avec une méthodologie simplifiée [ 114 ]. Sur 777 professionnels de santé de l’hôpital universitaire de Bâle ayant reçu une dose de rappel du vaccin contre la COVID-19 entre fin 2021 et début 2022, des signes de cardiomyonécrose (troponinémie) ont été détectés chez 22 d’entre eux (2,8 %), sans autre cause que l’injection de rappel du vaccin Moderna COVID-19 mRNA-1273 [ 114 ]. Bien que menée auprès d’une population différente, ayant reçu la deuxième dose de vaccin à ARNm, l’étude thaïlandaise a rapporté un taux de 2,3 % de myocardite ou de péricardite. Compte tenu des milliards de doses administrées à la population mondiale, cela équivaudrait à 2 300 cas pour 100 000 habitants. Tous les cas étant des hommes, le taux était de 3,5 % chez les adolescents de sexe masculin [ 113 ].
Bien que les autorités de santé publique affirment que la myocardite induite par les vaccins contre la COVID-19 est bénigne et spontanément résolutive, les données montrent que, même si cela peut être le cas sur le plan symptomatique, les lésions pathologiques du cœur de ces jeunes patients persistent. Une étude italienne a suivi pendant 12 semaines 13 cas de myopéricardite, de myocardite ou de péricardite post-vaccinale à ARNm, chez des sujets d’âge médian de 15 ans. Si les symptômes manifestes ont disparu chez tous les patients sauf un, 12 des 13 adolescents présentaient encore un épanchement péricardique et, à la fin de l’étude, six des neuf patients ayant bénéficié d’une IRM cardiaque présentaient des signes de « lésions myocardiques persistantes, bien qu’atténuées » [ 115 ].
La myocardite infraclinique induisant une fibrose cardiaque, foyer d’arythmie ultérieure en situation de stress, pourrait expliquer l’épidémie de morts subites chez les jeunes et les adultes d’âge moyen observée depuis l’introduction des vaccins contre la COVID-19 [ 116 , 117 ]. Cette possibilité a été évoquée par la TGA dès le début de la campagne de vaccination [ 118 ].
« Même des épisodes de myocardite apparemment bénins peuvent entraîner des séquelles à long terme, telles que des arythmies. … la majorité des cas de myocardite et/ou de péricardite survenus après la vaccination contre la COVID-19 par les vaccins à ARNm (Pfizer et Moderna) analysés à ce jour concernent des adolescents plus âgés et de jeunes adultes (de 16 à 30 ans), le risque étant le plus élevé chez les jeunes hommes dans les jours suivant la deuxième dose ».
[ 118 ] (p. 8)
7.1.2. Effets thrombotiques des protéines Spike
Indépendamment de la pathogenèse de la myocardite, la liaison de la protéine Spike induite par le vaccin contre la COVID-19 aux récepteurs ACE2 peut déclencher l’agrégation plaquettaire, la thrombose et l’inflammation, entraînant ainsi la formation de caillots sanguins [ 119 , 120 ]. Angeli et al. [ 99 ] résument la voie biochimique à l’origine de ces effets physiopathologiques :
Les protéines Spike libres , libérées par les cellules détruites et préalablement ciblées par les vaccins, peuvent interagir avec l’ACE2 d’autres cellules, favorisant ainsi l’internalisation et la dégradation de l’ACE2 (16, 79). Ce mécanisme peut accentuer le déséquilibre entre l’hyperactivité de l’Ang-II et le déficit en Ang-1-7 par la perte d’activité du récepteur ACE2, ce qui peut contribuer au déclenchement d’une inflammation, d’une thrombose, d’une augmentation de la pression artérielle et d’autres effets indésirables (« effet Spike » des vaccins contre la COVID-19) (80, 81). De plus, les effets néfastes d’un déficit en d’autres angiotensinases (POP et PRCP) sur la pression artérielle, la thrombose et l’inflammation sont bien documentés .
[ 120 ] (p. 24)
Les auteurs décrivent les mécanismes par lesquels ces effets sur la coagulation sont plus fréquents chez les patients plus jeunes. Les angiotensinases prolyl oligopeptidase (POP) et prolyl carboxypeptidases (PRCP) deviennent déficientes chez les personnes âgées atteintes de maladies cardiovasculaires et, paradoxalement, cela se traduit par une moindre susceptibilité à la pathogenèse cardiovasculaire induite par la protéine Spike, alors que chez les personnes plus jeunes, le risque est accru.
« La déficience relative de POP et de PRCP chez les sujets jeunes et en bonne santé ne compense pas l’internalisation, la régulation négative et le dysfonctionnement de l’ACE-2 dus aux interactions de la protéine Spike libre, ce qui entraîne un risque accru d’accumulation d’Ang-II et de réactions indésirables (« effet Spike » des vaccins contre la COVID-19) ».
[ 120 ] (p. 26)
Ils suggèrent également qu’une immunité préexistante acquise suite à une infection par le SARS-CoV-2 ou à une vaccination antérieure induit des réponses immunitaires plus importantes à la production de la protéine Spike par certaines cellules, comme les plaquettes, les cellules endothéliales vasculaires ou les myocytes, ce qui entraîne une augmentation de l’inflammation et de l’activité thrombogène. Dans Angeli et al. [ 119 ], ils concluent :
Alors que les essais vaccinaux de phase III excluaient généralement les participants déjà vaccinés, la vaccination de populations importantes en situation réelle inclura inévitablement des individus possédant une immunité préexistante. Ceci pourrait entraîner, chez certains sujets, des réactions inflammatoires et thrombotiques excessives. Des recherches supplémentaires sont donc nécessaires de toute urgence dans ce domaine.
La microscopie électronique en temps réel a montré que les protéines de spicule libres induisent la déformation et la coagulation des plaquettes par induction de filopodes et interaction des protéines de spicule avec les intégrines plaquettaires, provoquant ainsi une coagulopathie [ 121 ]. Au début de la pandémie, des souris transfusées avec des plaquettes exprimant le récepteur ACE2 humain transgénique ont développé des thrombus suite à la liaison des protéines de spicule aux récepteurs ACE2 présents à la surface des plaquettes [ 1 ]. Les auteurs ont noté :
« Le SARS-CoV-2 et sa protéine Spike ont directement stimulé les plaquettes pour faciliter la libération de facteurs de coagulation, la sécrétion de facteurs inflammatoires et la formation d’agrégats leucocytes-plaquettes . »
[ 1 ] (résumé)
Il a également été constaté que la protéine Spike « inhibe de manière compétitive la liaison de l’antithrombine et du cofacteur II de l’héparine à l’héparine/HS, entraînant une augmentation anormale de l’activité de la thrombine » [ 122 ]. Dans une autre étude chez la souris, il a également été constaté que la protéine Spike « se lie au fibrinogène, facteur de coagulation sanguine, et induit la formation de caillots sanguins structurellement anormaux présentant une activité pro-inflammatoire accrue », et que « la protéine Spike retarde la fibrinolyse » [ 123 ] (prépublication).
Des chercheurs français de l’Institut Méditerranée Infection de Marseille ont étudié in vitro les effets des protéines Spike des variants Wuhan, alpha, delta et omicron BA.1 du SARS-CoV-2 sur les globules rouges (érythrocytes). Ils ont constaté que la protéine Spike induisait une hémagglutination (agrégation) des érythrocytes, le variant omicron BA.1 atteignant cette concentration dès 0,13 ng/µL, tout comme les variants précédents. Le mécanisme d’action, déduit par modélisation moléculaire, est lié à la charge positive de la protéine Spike qui réduit la répulsion électrostatique naturelle des érythrocytes, chargés négativement. Fait intéressant, l’ivermectine, ajoutée à la solution in vitro, se lie fortement à la protéine Spike et prévient ou inverse l’hémagglutination selon qu’elle est ajoutée avant ou après la protéine Spike. Les auteurs soulignent les implications de ces résultats pour le traitement des effets indésirables des vaccins [ 124 ].
Les membranes plasmiques et internes des autres cellules eucaryotes peuvent être considérées comme fonctionnant grâce à des anions et des cations agissant comme une boucle de courant, générant un potentiel membranaire de part et d’autre de la membrane cellulaire [ 125 , 126 ]. La structure unique du globule rouge est un tore sur lequel circulent également des courants. Si ce flux statique à la surface de la membrane érythrocytaire est interrompu par un défaut de séparation entre la charge négative de la surface membranaire et la couche de Stern, l’affaiblissement du potentiel zêta entraîne une déformation, une diminution de la permittivité électrique, une augmentation de la viscosité, une floculation et des altérations rhéologiques [ 127 ]. Lorsque ce flux de courant de surface est statique, avec une séparation efficace entre la couche de Stern chargée positivement et les charges négatives de la surface membranaire, le potentiel zêta est renforcé et la taille, la forme, les proportions et la courbure de l’érythrocyte se transforment pour atteindre une forme optimale. Les érythrocytes doivent conserver une forme discoïde biconcave afin de transporter efficacement l’oxygène (O₂). 2 ) molécules et pour absorber les molécules de dioxyde de carbone (CO2 ) [ 128 ]. L’insertion d’une protéine de spicule positive dans la membrane érythrocytaire chargée négativement devrait donc entraîner des modifications importantes de la forme et de la fonction des érythrocytes.
Les complications thrombotiques de la vaccination contre la COVID-19 impliquent de nombreux mécanismes potentiels, tels que des lésions des cellules endothéliales, une réponse immunitaire, une dérégulation du système rénine-angiotensine-aldostérone et une thrombo-inflammation. De plus, les plaquettes contiennent de l’acétylcholine et expriment le récepteur nicotinique de l’acétylcholine α7 (α7nAchR). L’acétylcholine agit comme un inhibiteur endogène de l’agrégation plaquettaire. Un déficit hématopoïétique en α7nAchR augmente l’activation plaquettaire et, dans des études expérimentales, la stimulation de ce récepteur peut atténuer l’état pro-inflammatoire et moduler la réactivité plaquettaire via une augmentation des taux d’oxyde nitrique (NO). L’inhibition du récepteur nicotinique de l’acétylcholine plaquettaire par le SARS-CoV-2 favorise ainsi l’hyperréactivité plaquettaire et la thrombose, caractéristiques de la COVID-19 et des lésions vaccinales [ 129 ].
Ces mécanismes expliqueraient la coagulation induite à la fois par le virus et par les protéines de pointe produites par les vaccins anti-COVID-19 à thérapie génique. Ils suggèrent également que les politiques de santé publique qui ont remis en cause l’immunité naturelle et rendu obligatoire la vaccination contre la COVID-19, ainsi que les programmes de rappel, exposent davantage les jeunes et les personnes non âgées à un risque accru. Pour illustrer ces risques accrus, des cas de cécité ont été signalés dans les bases de données de pharmacovigilance et une vaste étude récente portant sur les diagnostics d’occlusion vasculaire rétinienne aux États-Unis, du 1er janvier 2020 au 31 décembre 2022, a révélé que les personnes vaccinées contre la COVID-19 avec les vaccins Moderna, Pfizer ou AstraZeneca présentaient un risque relatif accru de 2,19 par rapport aux Américains non vaccinés [ 130 ].
7.1.3. Thrombocytopénie thrombotique immunologique induite par la vaccination (VITT)
Contrairement au rôle de la protéine Spike dans la myopéricardite et la thrombogénèse décrit précédemment, le syndrome de thrombocytopénie thrombotique immunologique (TIVI) induite par la vaccination, observé avec les vaccins à ADN adénovecteur d’AstraZeneca et de Johnson & Johnson, ainsi qu’avec le vaccin russe Spoutnik V à ADN adénovecteur [ 131 ], est une affection rare médiée par les anticorps anti-PF4 sur les plaquettes. Ce syndrome semble sans lien avec la protéine Spike, et d’autres composants de la technologie à ADN adénovecteur font actuellement l’objet d’investigations [ 132 ]. Il est surprenant que ces vaccins aient été majoritairement retirés du marché, alors que les vaccins à ARNm contre la COVID-19, présentant des problèmes similaires malgré des mécanismes physiopathologiques différents, y sont restés.
Outre la présence d’anticorps anti-PF4 dans la pathogenèse de la VITT, de nombreux auteurs ont évoqué le rôle de la NETose (pièges extracellulaires de neutrophiles) comme mécanisme de thrombose observé avec les vaccins à vecteur adénoviral, indépendamment de la protéinémie Spike [ 133 , 134 ]. Talotta et Robertson suggèrent que la NETose pourrait également contribuer aux effets thrombophiliques des vaccins à ARNm, en soulignant par exemple que l’ARN nu, s’il s’échappe du vecteur LNP et se répand dans la circulation sanguine, peut déclencher la NETose [ 135 ].
7.2. Maladies auto-immunes
En 2020, avant le lancement des vaccins, Lyons-Weiler a suggéré que plus d’un tiers des protéines du SARS-CoV-2, dont la protéine Spike, présentaient une homologie problématique avec des protéines clés du système immunitaire humain. Il existe donc un risque de réactions auto-immunes contre ces protéines [ 8 ]. Vojdani et al. [ 9 ] ont cité Lyons-Weiler et ont approfondi leurs recherches en réalisant une cartographie des épitopes et en appliquant des anticorps monoclonaux anti-protéine Spike et anti-nucléoprotéine du SARS-CoV-2 à 55 antigènes tissulaires humains in vitro. Ils ont découvert que les anticorps anti-SARS-CoV-2 réagissaient avec 28 de ces antigènes, jouant ainsi probablement un rôle dans le processus pathologique multisystémique de la COVID-19 (résumé) et pouvant déclencher ou aggraver des maladies auto-immunes. Leur article a été soumis en octobre 2020 et ils ont noté des précédents historiques de vaccins provoquant des troubles liés à des maladies auto-immunes et ont exprimé leur inquiétude quant au fait qu’« un vaccin insuffisamment vérifié pourrait signifier échanger la liberté contre la COVID-19 contre une attaque auto-immune à l’avenir » (p. 2).
Vojdani et ses collègues ont découvert que les 28 antigènes présentaient un mimétisme moléculaire/une homologie partagée et une réactivité avec :
« Les protéines intestinales et de barrière, les cellules du système gastro-intestinal, la thyroïde, le système nerveux, le cœur, les articulations, la peau, les muscles, les mitochondries et les maladies du foie ».
[ 9 ] (p. 5)
Dans un article intitulé « Homologie entre les protéines du SARS-CoV-2 et les protéines humaines », Khavinson et al. ont identifié plus d’une vingtaine d’heptamères et d’octamères homologues à des protéines humaines, dont certains fusionnent pour former des séquences étendues le long de la protéine Spike du SARS-CoV-2 [ 136 ]. Ils ont noté que, compte tenu de cette « similarité structurale, une partie de la réponse immunitaire sera dirigée contre les protéines de l’organisme hôte » (p. 1).
Kelleni signale le risque potentiel des vaccins d’induire des maladies auto-immunes telles que la thrombocytopénie, la myocardite et la thrombose et la thromboembolie d’origine immunitaire, toutes potentiellement mortelles et causes possibles de mort subite [ 137 ].
Plus récemment, une équipe saoudienne a mis en évidence l’apparition clinique de maladies auto-immunes après la vaccination contre la COVID-19. Plusieurs cas de maladies auto-immunes d’apparition récente ont été décrits après cette vaccination. Le délai moyen entre la vaccination et l’apparition de la maladie était de 7 jours. Parmi les cas recensés figuraient des vascularites, des affections neurologiques, un lupus érythémateux systémique, des arthrites inflammatoires et un cas de syndrome de Sjögren [ 138 ]. Une revue systématique réalisée par Rodríguez et al. a documenté 928 cas, issus de 464 publications, de nouvelles apparitions ou de rechutes de maladies auto-immunes après la vaccination contre la COVID-19 [ 139 ]. Les auteurs ont noté :
« Les maladies les plus fréquemment associées aux nouveaux événements survenus après la vaccination étaient le purpura thrombopénique immunologique, la myocardite et le syndrome de Guillain-Barré. En revanche, le purpura thrombopénique immunologique, le psoriasis, la néphropathie à IgA et le lupus érythémateux systémique étaient les maladies les plus fréquemment associées aux épisodes de rechute . »
[ 139 ] (résumé)
Depuis la publication de l’article de Rodríguez et al., de nouveaux rapports de cas évalués par des pairs continuent d’apparaître. Parmi ces cas, on compte des affections dermatologiques et vasculaires auto-immunes attribuées aux vaccins contre la COVID-19, notamment un pemphigus à IgA où la « cause probable » était le vaccin AstraZeneca contre la COVID-19 [ 140 ] ; une maladie bulleuse auto-immune avec auto-anticorps IgG et IgM dirigés contre la zone de la membrane basale épidermique après vaccination contre la COVID-19 par un vaccin à ARNm [ 141 ] ; et une périartérite noueuse chez un homme de 32 ans présentant des « douleurs aux membres, de la fièvre, une embolie pulmonaire et de multiples nodules et hématomes sous-cutanés » après vaccination contre la COVID-19 [ 142 ].
Parmi les cas rapportés de maladies auto-immunes de la thyroïde et des reins, on note la maladie de Basedow survenue après la deuxième dose du vaccin Pfizer contre la COVID-19 [ 143 ] et une néphropathie à IgA rapidement progressive après la troisième dose du vaccin Moderna contre la COVID-19 [ 144 ]. Une femme de 78 ans a développé une sialadénite associée aux IgG4 et une pancréatite auto-immune après sa deuxième vaccination Pfizer contre la COVID-19. Les auteurs concluent : « L’utilisation des vaccins à ARNm nécessite des études complémentaires concernant leurs effets sur le système immunitaire humain » [ 145 ] (p. 1550).
Une femme de 23 ans a présenté une réaction auto-immune oculaire sous forme d’uvéite antérieure granulomateuse 15 jours après sa troisième injection du vaccin Pfizer contre la COVID-19 [ 146 ]. Les auteurs ont commenté :
« Une réaction auto-immune dans le tissu uvéal via un mimétisme moléculaire résultant d’une réponse immunitaire humorale adaptative et cellulaire polyspécifique contre des épitopes pourrait être le mécanisme potentiel de l’uvéite post-vaccinale chez ce patient . »
(p. 1034)
Un rapport de cas d’anémie aplasique associée à l’hépatite (HAAA) après vaccination contre la COVID-19 chez une jeune fille de 15 ans originaire du Japon [ 147 ] citait Talotta [ 148 ] et postulait :
« Les mécanismes pathogènes par lesquels la vaccination par ARNm déclenche le développement de maladies auto-immunes restent flous. La vaccination par ARNm induit une réactivité croisée potentielle entre les anticorps dirigés contre la protéine Spike et les auto-antigènes, et peut également activer des réponses immunitaires, entraînant la production d’interféron I et d’autres cytokines et chimiokines pro-inflammatoires . »
[ 148 ] (p. 3)
La stimulation antigénique répétée de l’immunité, comme c’est le cas avec la production prolongée de protéines Spike par les vaccins anti-COVID-19 à base de gènes, les doses de rappel répétées et les infections récurrentes au SARS-CoV-2, a entraîné une augmentation des taux d’IgG4 de plus de 480 fois par rapport aux taux normaux [ 149 , 150 ]. Ce changement de classe d’IgG peut être associé à des pathologies graves, notamment la mort subite cardiaque [ 151 , 152 ].
Il a également été associé au syndrome de Mikulicz avec atteinte systémique, à une maladie pancréato-hépatobiliaire, à une maladie de la tête et du cou, à une fibrose rétropéritonéale/aortite [ 153 , 154 , 155 , 156 ], ainsi qu’à une lymphadénopathie, une sialadénite, une dacryoadénite, une pancréatite auto-immune, une péri-aortite/fibrose rétropéritonéale, une prostatite, une cholangite sclérosante, une sinusite, une pseudotumeur inflammatoire, une fibrose médiastinale, une atteinte cutanée, une thyroïdite sclérosante, une hypophysite, une orchite et une colite [ 157 , 158 , 159 , 160 ].
Ces effets auto-immuns et pro-inflammatoires généralisés de la protéine Spike et potentiellement des nanoparticules lipidiques illustrent que la « spikeopathie » est un autre « grand imitateur » semblable à la tuberculose, ce qui rend difficile le diagnostic de l’étiologie sous-jacente [ 161 ].
7.3. Troubles neurologiques
Le groupe d’effets indésirables le plus fréquemment rapporté aux bases de données de pharmacovigilance, y compris les études post-commercialisation de Pfizer [ 162 , 163 ], n’est pas d’ordre cardiovasculaire mais neurologique. Les symptômes neurologiques et la détérioration cognitive, associés à une accélération de la neurodégénérescence, caractérisent la COVID-19 aiguë, les effets indésirables liés à la vaccination et, dans une certaine mesure, la COVID longue [ 164 ].
Le passage de l’ARNm codant pour la protéine Spike, encapsulé dans des nanoparticules lipidiques, à travers la barrière hémato , peut induire des effets neurotoxiques directs [ 43 -encéphalique (BHE) ]. Une altération de la BHE a été observée après la vaccination contre la COVID-19 [ 165 ], et la protéine Spike S1 peut traverser la BHE et se diffuser dans le parenchyme cérébral [ 166 , 167 ]. Des cultures cellulaires in vitro de cellules endothéliales cérébrales (composantes de la BHE) ont montré que la sous-unité S1 (RBD) se lie à l’ACE2 des cellules endothéliales pour traverser la BHE. La présence de la sous-unité S1 est corrélée à un dysfonctionnement mitochondrial et à son entrée dans les noyaux cellulaires ; les auteurs ont émis l’hypothèse qu’elle pourrait perturber l’expression génique [ 168 ].
7.3.1. Aspects neurovasculaires et neuroimmunologiques
La physiopathologie est probablement due, en partie, à des atteintes vasculaires et auto-immunes du système nerveux central et périphérique. Dans des cultures cellulaires humaines in vitro, la protéine Spike a été identifiée comme dérégulant les péricytes vasculaires cérébraux par l’augmentation de l’expression d’ACE2. Ces cellules, tapissant la vascularisation cérébrale, acquièrent alors un phénotype contractile et myofibogène, ainsi qu’une forte réponse inflammatoire exacerbée par l’hypoxie [ 169 ].
Dans d’autres expériences menées sur des souris, l’infusion de la protéine Spike dans le cerveau a induit une neuroinflammation médiée par TLR4 et une microgliose hippocampique, associées à des troubles de la mémoire. Chez l’humain, il a été observé que les troubles cognitifs post-COVID-19 étaient plus fréquents chez les souris présentant un génotype TLR4 particulier [ 170 ]. Ces résultats corroborent des expériences similaires réalisées chez la souris, montrant que l’infusion de la sous-unité S1 (RBD) dans l’hippocampe induisait la mort cellulaire et l’activation gliale, et que les souris présentaient des déficits cognitifs et un comportement de type anxieux [ 171 ].
Tillman et al. (2023) [ 172 ] ont décrit comment la co-expression des sous-unités S1 et S2 de la protéine Spike du SARS-CoV-2, via un motif hélicoïdal au niveau du col de la protéine, induit une forte diminution de l’expression des récepteurs nicotiniques α7 fonctionnels, impliqués dans les maladies neuropsychiatriques et perturbant la voie anti-inflammatoire cholinergique (p. 689). Des chercheurs allemands [ 173 ] (prépublication) ont autopsié des souris ayant reçu une injection intraveineuse de la sous-unité S1 de la protéine Spike et examiné des crânes humains autopsiés. Ils ont constaté que la sous-unité S1 se liait aux cellules de la plupart des organes, notamment les ovaires et les testicules. Dans le cerveau, ils ont observé la présence de S1 associée à une expression différentielle de protéines, suivant l’expression connue des récepteurs ACE2, dans la moelle osseuse, les méninges et le parenchyme cérébral, comparativement aux témoins. La protéine S1 a été observée dans diverses régions du cerveau, notamment au niveau des canaux reliant la moelle osseuse crânienne aux méninges (SMC), chez la souris comme chez l’humain. Ceci suggère qu’en plus de sa distribution par les cellules phagocytaires ou par extravasation directe à partir des vaisseaux sanguins, elle pourrait emprunter ces canaux comme voies de passage à travers le crâne. La protéine S1 s’est accumulée dans la moelle du tibia et du fémur, ainsi que dans la moelle épinière.
À partir de données protéomiques humaines, les auteurs ont mis en évidence une dérégulation des cascades du complément et de la coagulation, concordant avec les coagulopathies connues après injection. Les voies de signalisation liées aux neutrophiles étaient dérégulées : certaines protéines étaient surexprimées, tandis que d’autres étaient sous-exprimées. Parmi les protéines surexprimées figuraient des protéines associées à l’inflammation, telles que l’interféron gamma (IFN-γ) et le ligand 10 de la chimiokine à motif CXC (CXCL10), induit par l’IFN-γ. D’autres modifications protéiques étaient impliquées dans la formation de pièges extracellulaires de neutrophiles (NETose), la dégranulation des neutrophiles et les voies de signalisation de la phosphatidylinositol 3-kinase/protéine kinase B (PI3K-AKT). Dans les méninges, les protéines surexprimées étaient également associées à l’activation, à la signalisation et à l’agrégation plaquettaires. Dans le cortex cérébral, on observait des niveaux altérés de protéines ribosomiques et une dérégulation des voies de neurodégénérescence. Les taux de cytokines plasmatiques et d’IL-6 plasmatique ont augmenté trois jours après l’injection de la protéine S1.
Outre l’injection expérimentale de la sous-unité S1 de la protéine Spike à des souris, les chercheurs ont autopsié 34 patients décédés de maladies autres que la COVID-19 et ont constaté la persistance de la protéine Spike dans le crâne de 10 d’entre eux. Ils ont suggéré que cette protéine pourrait être impliquée dans les symptômes persistants de la COVID longue, via sa diffusion à travers les méninges vers le parenchyme cérébral. En résumé, la protéine Spike s’accumule dans différentes régions du cerveau, y persiste même après la mort et provoque l’activation de la microglie, le blocage des récepteurs nicotiniques de l’acétylcholine α7 et la dérégulation des voies de coagulation et des voies liées aux neutrophiles, ainsi que la surexpression de protéines inflammatoires. Tous ces phénomènes sont associés à des pertes de mémoire, à une inflammation cérébrale et à la mort cellulaire [ 173 ].
Il est à noter que l’infection par le SARS-CoV-2, en particulier par les premiers variants, peut entraîner une perte d’odorat et présente donc une neurotoxicité au niveau du nerf olfactif. Les mécanismes d’action neurotoxique du virus et des vaccins contre la COVID-19 à base de gènes font actuellement l’objet de recherches.
Olajide et al. [ 174 ] ont proposé que la glycoprotéine Spike du SARS-CoV-2 induise une neuroinflammation via ses effets sur la microglie par :
« L’induction d’une neuroinflammation par cette protéine dans la microglie est médiée par l’activation de NF-κB et de p38 MAPK, possiblement à la suite de l’activation de TLR4. »
[ 174 ] (Résumé, p. 445)
L’ activation des cellules microgliales BV-2 par la protéine S1 a entraîné une augmentation de la libération de TNF-α, d’IL-6 et d’IL-1β, marqueurs de la neuroinflammation. L’activation des processus neuro-inflammatoires par la protéine S1 a été confirmée par des résultats montrant une augmentation de la production de NO, médiée par l’iNOS, au sein des cellules microgliales. Un taux élevé d’iNOS/NO a déjà été associé à de nombreux troubles du SNC, notamment la maladie d’Alzheimer, la maladie de Parkinson, la sclérose en plaques, l’épilepsie et la migraine .
[ 174 ] (p. 452–453)
Dans une expérience de culture cellulaire in vitro, la protéine Spike a été impliquée dans l’augmentation de l’expression de l’alpha-synucléine (α-Syn), une protéine sujette à l’agrégation qui est en outre impliquée dans la pathogenèse des corps de Lewy, qui sont des lésions caractéristiques dans le cerveau des patients atteints de la maladie de Parkinson, de la démence à corps de Lewy et d’autres maladies neurodégénératives [ 175 ].
Winkler et al. [ 176 ] ont induit une forme légère de COVID-19 respiratoire chez un modèle murin exprimant l’ACE2 humaine dans la trachée et les poumons, par exposition intranasale au SARS-CoV-2. Ils n’ont détecté aucun SARS-CoV-2 dans le cerveau, mais ont observé des signes de neuroinflammation ainsi qu’une élévation des taux de chimiokines dans le liquide céphalo-rachidien et le sérum. Ces modifications ont entraîné l’activation de la microglie dans la substance blanche sous-corticale et hippocampique. La microglie, souvent considérée comme le macrophage du système nerveux central, assure le maintien des réseaux neuronaux en éliminant les épines dendritiques et les synapses au cours du développement neuronal. Chez la souris, son activation a cependant induit un état neurotoxique qui, dans la substance blanche sous-corticale, a provoqué la disparition des précurseurs et des oligodendrocytes matures.
De plus, la myéline et les axones myélinisés ont diminué pendant au moins sept semaines après l’infection, affectant la structure et la fonction des réseaux neuronaux. Les maladies démyélinisantes figurent parmi les effets indésirables connus des injections d’ARNm. Dans l’hippocampe, l’activation de la microglie était associée à une neurogenèse inhibée, ce qui pourrait expliquer les troubles de la mémoire observés chez les patients. Cette activation microgliale semblait être médiée par des taux constamment élevés d’une molécule appelée chimiokine à motif CC 11 (CCL11). La CCL11 a été associée au vieillissement et à l’inhibition de la neurogenèse [ 177 , 178 ], ainsi qu’aux allergies et au recrutement des éosinophiles [ 179 ].
Fernández-Castañeda et al. [ 180 ] ont étudié les effets d’une infection respiratoire bénigne au SARS-CoV-2 chez un modèle murin. Ils ont mis en évidence des modifications des cytokines et chimiokines neuro-inflammatoires, notamment de la protéine CCL11, dans le liquide céphalo-rachidien et le sérum sur une période de sept semaines après le début de l’infection. Ils ont également observé des modifications spécifiques à certaines régions cérébrales de la substance blanche sous-corticale, avec une activation de la microglie et une perte subséquente d’oligodendrocytes, de cellules précurseurs d’oligodendrocytes et de myéline.
D’autres auteurs ont montré que la protéine CCL11 augmente la proportion de lymphocytes T régulateurs CD4+CD25+Foxp3+, l’expression de CCR3 et de Foxp3, ainsi que la libération d’IL-2 et de TGFβ1 dans les lymphocytes T CD4+ non associés aux tumeurs, via la voie de signalisation STAT5 [ 60 ]. Les lymphocytes T régulateurs sont immunosuppresseurs et orientent la réponse immunitaire vers la tolérance immunitaire. Ceci concorde avec les résultats d’une équipe allemande [ 149 ] qui a démontré que la vaccination avec des complexes ARNm-LNP induit une modification générale du profil des anticorps, passant des IgG1 et IgG3 inflammatoires aux IgG4. Cette modification est associée aux lymphocytes T régulateurs et à la tolérance immunitaire, et survient après la deuxième vaccination. La proportion d’anticorps IgG4 spécifiques de la protéine Spike est passée de 0,04 % peu après la deuxième dose à 19,27 % tardivement après la troisième dose. Démontrant l’effet de tolérance, une vaste étude de la Cleveland Clinic sur le personnel a révélé que l’augmentation des IgG4 avec les doses de rappel ultérieures est corrélée à une susceptibilité accrue à l’infection par le SARS-CoV-2 [ 181 ].
Les chimiokines, comme l’éotaxine CCL11 (éotaxine-1), sont produites localement par les cellules épithéliales, mésenchymateuses et endothéliales et jouent un rôle crucial dans la migration et l’activation des éosinophiles, ainsi que dans la sécrétion de médiateurs une fois qu’ils ont atteint les voies respiratoires [ 182 , 183 ]. Les éosinophiles sécrètent diverses protéines basiques pro-inflammatoires dans leurs granules, notamment la protéine basique majeure, la protéine cationique éosinophile, la neurotoxine dérivée des éosinophiles et la peroxydase éosinophile [ 184 ].
Une autre étude a examiné le domaine de type toxine de la protéine RBG sur S1, qui se lie au récepteur nAChR α7, augmentant les taux d’IL-1β et de TNF- α dans le cerveau et altérant la mémoire épisodique chez la souris [ 178 ]. Comme mentionné précédemment, le blocage de ce récepteur par la protéine Spike pourrait induire une inflammation importante, car il régule la production de cytokines pro-inflammatoires.
Le récepteur nicotinique de l’acétylcholine (nAChR) est fortement exprimé dans l’hippocampe, le cortex et plusieurs régions limbiques. Il est impliqué dans la cognition, le traitement de l’information sensorielle, l’attention, la mémoire de travail et le circuit de la récompense. Une réduction de l’isoforme α7 dans le cerveau, notamment dans l’hippocampe, a été observée chez les patients atteints de la maladie d’Alzheimer. Outre sa capacité à se lier au nAChR α7 de manière similaire à une neurotoxine, la protéine Spike s’est révélée amyloïdogène [ 185 ]. On sait que les peptides β-amyloïdes (Aβ) associés à la maladie d’Alzheimer se lient aux nAChR avec une affinité picomolaire et que les α-neurotoxines de serpent inhibent cette liaison de manière compétitive [ 186 ]. L’interaction de l’amyloïde et de la protéine Spike avec les récepteurs nAChR est connue depuis longtemps. La modélisation informatique in silico du mécanisme de liaison à l’amyloïde démontre une similarité avec celui du venin de serpent. Il a donc été proposé que l’interaction avec l’AChR permette un changement conformationnel de l’amyloïde, bloquant ainsi l’ouverture du canal. À l’instar du venin de serpent, l’amyloïde active initialement le canal AChR à faibles concentrations, puis ralentit et bloque sa fonction. De faibles concentrations (picomolaires) de peptides Aβ solubles dans le cerveau de personnes saines jouent des rôles physiologiques, tandis que dans la maladie d’Alzheimer, les concentrations augmentent jusqu’à atteindre le nanomolaire et déclenchent la formation de plaques insolubles, une caractéristique neuropathologique majeure de la maladie d’Alzheimer. 187 ].
7.3.2. Formation de prions et effets neurodégénératifs
Les maladies neurodégénératives telles que la maladie d’Alzheimer, la maladie de Parkinson et la sclérose latérale amyotrophique (SLA) sont toutes associées à des protéines mal repliées qui s’accumulent en plaques et en corps de Lewy. Ces protéines, dites amyloïdogènes, sont également qualifiées de « de type prion ». Le domaine C-terminal de type prion de la protéine TDP-43 et de l’α-synucléine interagissent en synergie pour générer des fibrilles hybrides neurotoxiques [ 188 ]. Il existe donc au moins deux mécanismes par lesquels la protéine Spike, via le récepteur nicotinique α7 (α7 nAChR), pourrait contribuer aux troubles neurodégénératifs : l’inhibition directe et l’inhibition amyloïdogène secondaire.
Le domaine de liaison au récepteur de la protéine Spike du SARS-CoV-2 présente des propriétés de type prion, est le seul coronavirus à posséder de telles propriétés, et présente une affinité de liaison virale accrue pour le récepteur ACE2, augmentant ainsi l’infectiosité et la transmissibilité chez l’humain [ 189 ]. La protéine Spike complète, avec sa sous-unité S1 du domaine de liaison au récepteur (RBD) intact, si elle traverse la barrière hémato-encéphalique, présente donc des propriétés de type prion qui justifient des recherches plus approfondies sur ses effets pathogènes potentiels.
De plus, les vaccins à ARNm ou à ADN adénovectoriel contiennent des séquences protéiques capables d’induire l’agrégation des protéines TDP-43 et FUS (impliquées dans la liaison ARN/ADN et la régulation de l’ARN) en une structure prion. Ceci pourrait potentiellement conduire à des maladies neurodégénératives, telles que la maladie d’Alzheimer [ 190 , 191 ]. Le lien avec les maladies neurodégénératives réside dans la capacité de la protéine Spike à interagir avec des protéines se liant à l’héparine et formant des amyloïdes [ 192 ]. Bien que spéculatives, ces considérations sont étayées par un cas rapporté de maladie à prions suite à une vaccination [ 193 ]. Lors d’une expérience in vitro, la protéine Spike a été clivée en fragments plus petits par l’élastase des neutrophiles, certains de ces fragments présentant des propriétés amyloïdogènes [ 185 ].
Certaines séquences primaires des sialoglycoprotéines neuronales permettent à ces protéines d’adopter diverses structures alternatives capables d’auto-réplication conformationnelle par l’intermédiaire de copies de la même protéine servant de matrice. Cette conversion en prions modifie généralement de façon radicale la fonction de la protéine, la rendant souvent transmissible [ 194 ]. Les prions sont donc constitués de l’isoforme mal repliée et amyloïdogène de la protéine prion.
Les maladies à prions, telles que la maladie de Creutzfeldt-Jakob (MCJ), sont des affections neurodégénératives fatales dues à la vacuolisation et à des lésions neuropathologiques spongiformes, associées à une neurodégénérescence rapide et à l’activation des astrocytes et de la microglie [ 195 ]. L’accumulation neuronale de protéines mal repliées est impliquée dans la pathogenèse d’autres maladies neurodégénératives, notamment les maladies d’Alzheimer et de Parkinson [ 196 , 197 ]. Les maladies infectieuses à prions peuvent également induire des effets neurocognitifs non spécifiques [ 198 ].
Des cas de MCJ ont également été documentés après la vaccination contre la COVID-19 ; un cas est survenu dès 5 jours après la vaccination [ 199 ] et un autre a entraîné le décès 6 mois plus tard [ 200 ]. En Australie, le nombre de décès liés à la démence pour la période janvier-février 2022 a augmenté de 27,2 % par rapport à la période de référence 2017-2021 (qui comprenait la première vague de COVID-19) pour les mêmes mois, et le taux de mortalité lié à la démence continue d’augmenter depuis [ 201 , 202 ].
Des symptômes neurologiques sont fréquemment observés après une infection au COVID-19, dans le cas du « COVID long » et après une vaccination par ARNm, ce qui soulève la possibilité d’une implication des prions.
Les mécanismes potentiels par lesquels la vaccination contre la COVID-19 par ARNm pourrait produire des prions et déclencher des processus neurodégénératifs incluent : l’activation de protéines de liaison à l’ARN telles que la protéine de liaison à l’ADN TAR (TDP-43) et la protéine Fused in Sarcoma (FUS), qui peuvent former des prions pathogènes ; les dimères de TDP-43 se lient à l’ARN riche en UG ou à l’ADN riche en TG et sont résistants à la dégradation [ 203 ] ; la liaison à ces séquences d’ARN lorsque les protéines sont cytoplasmiques peut entraîner un repliement incorrect conduisant à la formation de prions [ 204 ]. Il est donc préoccupant que le vaccin Pfizer utilise un nucléoside d’ARN unique, le 1-méthyl-3’-pseudouridylyle (Ψ), et que de multiples motifs d’uracile aient été trouvés dans l’ARNm du vaccin [ 191 ].
Outre les séquences d’uracile présentes dans l’ARNm, susceptibles de se lier aux protéines et d’induire un repliement incorrect, des domaines de type prion ont été identifiés in silico dans le RBD de la sous-unité S1 de la protéine Spike. Le SARS-CoV-2 est le seul coronavirus possédant un tel domaine, ce qui lui confère une affinité 10 à 20 fois supérieure pour le récepteur ACE2 par rapport au SARS-CoV-1, en plus de son potentiel prion [ 189 ].
De plus, le domaine de liaison au ribosome (RBD) de la protéine Spike possède plusieurs sites de liaison à l’héparine qui peuvent interagir avec l’héparine et les protéines amyloïdes se liant à l’héparine, suggérant que ce peptide est susceptible d’agir comme un amyloïde fonctionnel et de former des agrégats toxiques [ 205 ]. Il a été démontré que la protéine S1 se lie de manière stable aux protéines sujettes à l’agrégation Aβ, α-synucléine, tau, prions et TDP-43 et pourrait ainsi initier l’agrégation de ces protéines et la neurodégénérescence subséquente [ 192 ].
Les chercheurs ont également identifié un motif de type « fermeture éclair à glycine » au sein de la sous-unité S1, lié à une susceptibilité au repliement incorrect et, par conséquent, à la formation de prions. Ce motif est caractérisé par une séquence de deux résidus de glycine séparés par trois acides aminés, représentée par GxxxG. Le motif GxxxG est une caractéristique commune des protéines transmembranaires, et les glycines jouent un rôle essentiel dans la réticulation des hélices α de la protéine [ 206 ]. Les protéines prions deviennent toxiques lorsque les hélices α se replient incorrectement en feuillets β, ce qui altère la capacité de la protéine à pénétrer dans la membrane [ 207 ]. La protéine précurseur de l’amyloïde-β (APP) possède quatre motifs GxxxG : la glycine joue un rôle central dans le repliement incorrect de l’amyloïde-β associé à la maladie d’Alzheimer [ 208 ]. La protéine Spike du SARS-CoV-2 est une protéine transmembranaire qui contient cinq motifs GxxxG dans sa séquence (voir uniprot.org/uniprot/P0DTC2 ) , dont un dans le RBD, et il est donc plausible qu’elle puisse se comporter comme un prion [ 209 ].
Un autre mécanisme proposé est l’induction spontanée de prions et de protéines de type prion par les espèces réactives de l’oxygène (ERO). La production excessive d’ERO et l’altération présumée de la fonction mitochondriale, associées à des troubles cognitifs, caractérisent à la fois les formes aiguës sévères de la COVID-19, la COVID longue [ 198 ] et la spikeopathie. En situation de stress, les protéines TDP-43, FUS et d’autres protéines de liaison à l’ARN migrent du noyau vers le cytoplasme et s’associent aux granules de stress [ 210 , 211 ]. Lorsque le stress se dissipe, les granules de stress se désagrègent et les protéines de liaison à l’ARN retournent au noyau. Un stress environnemental accru, accompagné d’un excès d’ERO (par exemple, exposition à des toxines, traumatisme, infection virale), pourrait entraîner une perte de fonctionnement normal du protéasome et une restauration de sa conformation normale, augmentant ainsi la probabilité d’une agrégation inappropriée des protéines de liaison à l’ARN [ 212 , 213 ].
L’effet de la neuroinflammation, notamment l’activation des astrocytes, est similaire. Des études animales démontrent une transition accélérée des stades précliniques aux stades cliniques de la maladie à prions en cas de co-infection, associée à une neuroinflammation, une élévation des cytokines pro-inflammatoires et une activation accrue des astrocytes réactifs à A1 [ 214 ]. Le TNF et le C1q produits par la microglie activée activent davantage les astrocytes A1 [ 215 ], lesquels seraient neurotoxiques en induisant des lésions neuronales et en servant de foyers de propagation des prions [ 216 ]. Il a également été démontré que les anticorps non neutralisants, après vaccination contre des peptides de la protéine Spike chez la souris, activent les cellules gliales et les astrocytes [ 217 ], ce qui concorde avec le mécanisme proposé d’activation des astrocytes, de formation des prions et de dysfonctionnement cognitif.
Dans une revue narrative exhaustive des mécanismes physiopathologiques potentiels de la protéine Spike dans les maladies neurodégénératives, Seneff et ses collègues décrivent « la contribution de la protéine Spike, via ses propriétés de type prion, à la neuroinflammation et aux maladies neurodégénératives ; aux troubles de la coagulation vasculaire ; et à l’aggravation du risque de maladie due à la dérégulation de la protéine prion dans un contexte de résistance à l’insuline très répandue ». Ils expliquent également « pourquoi ces caractéristiques de type prion sont plus pertinentes pour les protéines Spike induites par l’ARNm dans le cadre des vaccins que pour l’infection naturelle par le SARS-CoV-2 » [ 29 ] (résumé p. 1). Parmi les principaux résultats analysés :
- L’endothéliite induite par les pointes perturbe la barrière hémato-encéphalique et exacerbe la maladie d’Alzheimer via l’interaction de la protéine de pointe avec l’amyloïde β ou la protéine tau hyperphosphorylée [ 164 ].
- Des études ont montré que les auto-anticorps dans le domaine C-terminal globulaire peuvent provoquer une forme agressive de la maladie de Creutzfeldt-Jakob (MCJ) en interférant avec le transport de la protéine prion dans le réticulum endoplasmique [ 218 ].
- La protéine Spike elle-même, qui est également une protéine de liaison à l’ARN, peut faciliter la transcription inverse de l’ARNm de la protéine Spike en ADN, médiée par LINE-1. Les neurones expriment activement LINE-1 en association avec les maladies neurodégénératives [ 219 , 220 ].
- Les cellules qui absorbent l’ARNm contenu dans les nanoparticules lipidiques des vaccins à ARNm encapsulent une partie de cet ARNm, associé aux lipides cationiques ionisables, dans de petites particules lipidiques libérées sous forme d’exosomes, qui peuvent être transportés dans tout l’organisme [ 59 , 221 ]. Par exemple, une cellule immunitaire de la rate pourrait transporter l’ARNm intact codant pour la protéine Spike jusqu’au cerveau via le nerf vague, où un neurone ou une cellule microgliale pourrait alors initier la synthèse de cette protéine.
- Les microARN (miARN) sont de petits fragments d’ARN fonctionnels, capables de réguler activement les fonctions cellulaires, notamment l’embryogenèse et l’apoptose. Le miR-146a est présent dans les exosomes libérés par les cellules immunitaires et figure parmi les miARN dont l’expression est modifiée en lien avec la COVID-19 [ 222 ]. Les exosomes qui atteignent le tronc cérébral transportent non seulement la protéine Spike, mais potentiellement aussi des molécules d’ARNm et de miARN intactes, dont le miR-146a, impliqué dans les infections virales et les maladies à prions cérébrales [ 223 , 224 ].
- La protéine Spike induit elle-même une forte augmentation de l’expression du TNF-α et provoque des troubles cognitifs, ce qui pourrait indiquer qu’elle augmente l’expression de la protéine prion (PrP) dans le cerveau. Une augmentation de la glycoprotéine prion (PrP) C ) nombres peuvent conduire à un mauvais repliement de la conformation du prion et générer des prions et des maladies liées aux prions [ 225 , 226 ].
- Il a été démontré que la protéine Spike induit la sénescence dans les cellules transfectées [ 227 ]. De plus, il a été suggéré que les vaccins à ARNm contre la COVID-19 peuvent induire une sénescence prématurée par la formation de syncytia dans les cellules immunitaires exposées, principalement en raison de leur teneur en lipides (lipides ionisables, cholestérol et phospholipide 1,2-distéaroyl-sn-glycéro-3-phosphocholine (DSPC)) [ 228 ]. Des études moléculaires in vitro montrent que l’encombrement macromoléculaire peut faciliter la conversion de la PrP native en une configuration d’oligomère β soluble neurotoxique [ 229 ].
7.3.3. Dysautonomie
Une autre caractéristique importante de l’infection ou de la vaccination contre la COVID-19 est la dysautonomie (DSN), un trouble neurologique affectant le système nerveux autonome (SNA), avec des répercussions importantes sur le cœur, la vessie, les glandes sudoripares, les pupilles, les intestins et d’autres systèmes autonomes. Les systèmes nerveux sympathique (SNS) et parasympathique (PSNS) sont tous deux touchés, avec un risque de tempête sympathique et de réponses autonomes anormales, notamment une transpiration excessive, une intolérance à l’effort, des insomnies, une tachycardie au repos, une hypotension orthostatique, de la fatigue et des troubles urinaires et intestinaux. La nature neuroinvasive du SARS-CoV-2 entraîne des complications neurologiques telles que la DSN [ 96 ] et suggère soit une lésion neuronale autonome directe, soit des mécanismes indirects à médiation immunitaire, comme cela se produirait en cas d’inhibition des récepteurs nicotiniques α7 (nAChR). L’inhibition des nAChR par le SARS-CoV-2 peut conduire à l’inhibition du PSNS et à une exacerbation du SNS, avec une progression ultérieure de la tempête cytokinique [ 94 ].
Un autre dysfonctionnement neurologique associé à la COVID-19 est l’anosmie, symptôme fréquent de la COVID-19 et également prodromique de la maladie de Parkinson. Le bulbe olfactif possède un réseau dense de récepteurs nicotiniques de l’acétylcholine (nAChR), et les récepteurs α7 nAChR pourraient également être exprimés à la surface des terminaisons axonales olfactives. Ceci pourrait faciliter l’infection du système nerveux central par transport antérograde le long du nerf olfactif. L’anosmie pourrait ainsi constituer un autre signe de dysfonctionnement du système cholinergique nicotinique dans la COVID-19 [ 32 ].
Ces effets neuropathologiques potentiels sont très préoccupants, compte tenu du caractère expérimental des vaccins à ARNm, de la pathogénicité de la protéine Spike du SARS-CoV-2 et de la capacité de la matrice porteuse de nanoparticules lipidiques à traverser la barrière hémato-encéphalique.
7.4. Effets cancérogènes
À ce jour, aucune preuve concluante ne permet d’établir un lien entre les injections d’ARNm et le cancer. Des témoignages anecdotiques, relayés par la presse et des médecins du monde entier, font état de réactivations de cancers après des années de rémission. Ces cancers, dits « turbocancers », progressent rapidement vers des stades avancés, voire entraînent la mort. Le professeur Angus Dalgleish, oncologue de renom ayant étudié le potentiel anticancéreux des vaccins [ 230 ], a suscité de vives critiques en affirmant que ce phénomène se produit après la vaccination contre la COVID-19. Il a adressé une lettre au rédacteur en chef du BMJ , publiée ensuite en tant que lettre ouverte [ 231 ].
Il est trop tôt pour tirer des conclusions définitives ; toutefois, nous pouvons examiner la protéine Spike et son potentiel cancérigène ou susceptible d’affaiblir le système immunitaire au point de le rendre incapable de lutter efficacement contre le cancer. Dans sa lettre, Dalgleish a noté que la plupart des cas signalés après la vaccination contre la COVID-19 concernaient des « mélanomes ou des cancers à cellules B, très sensibles au contrôle immunitaire ».
La réponse immunitaire implique l’activation d’un réseau complexe de voies d’activation et d’inhibition. La défense immunitaire coexiste avec le maintien de la tolérance au soi, et l’équilibre entre ces processus est crucial. Les points de contrôle immunitaire jouent un rôle important dans la régulation de ce réseau. Un récepteur inhibiteur important est la protéine de mort cellulaire programmée 1 (PD-1, CD279), généralement présente sur les lymphocytes T, les lymphocytes B matures et d’autres cellules immunitaires [ 232 ]. Ses ligands, le ligand de mort programmée 1 (PD-L1) et PD-L2, sont régulièrement exprimés sur les cellules présentatrices d’antigènes telles que les cellules dendritiques et les macrophages ; une surexpression de PD-L1 est observée après l’activation des monocytes et des granulocytes [ 233 , 234 ].
Dans ce contexte, Loacker et al. [ 235 ] montrent que l’expression de PD-L1 des granulocytes et des monocytes périphériques des individus vaccinés est significativement plus élevée que chez les individus non vaccinés. Diskin et al. [ 236 ] ont constaté que l’expression de PD-L1 par les lymphocytes T dans le cancer était régulée par l’antigène tumoral et des signaux inflammatoires stériles. Les lymphocytes T PD-L1+ exercent une tolérance favorisant la tumeur [ 232 ] via (1) la liaison de PD-L1 induit une « rétro-signalisation » dépendante de STAT3 (transducteur de signal et activateur de la transcription 3) dans les lymphocytes T CD4+, ce qui empêche leur activation [ 233 ]. (2) Les lymphocytes T PD-L1+ inhibent les lymphocytes T effecteurs et accélèrent la tumorigénèse, même en l’absence de PD-L1 endogène, et (3) les lymphocytes T PD-L1+ interagissent avec les macrophages PD-1+ [ 234 ], induisant un programme alternatif de type M2, qui a des effets délétères sur l’immunité antitumorale adaptative. Ensemble, ces résultats démontrent que les lymphocytes T PD-L1+ induisent une tolérance immunitaire antitumorale.
De plus, Singh et Singh [ 87 ] ont démontré une interaction in vitro entre la sous-unité S2 de la protéine Spike et les protéines suppresseurs de tumeurs P53 et BRCA1 et BRCA2. Outre l’interaction directe, la transfection de cellules avec l’ARNm codant pour la protéine Spike entraîne la génération d’exosomes contenant des miRNA (miR-148 et miR-590), qui suppriment la production du facteur de régulation de l’interféron 9 (IRF9) et activent les transcrits de gènes pro-inflammatoires [ 237 ].
Il existe des preuves que la vaccination contre la COVID-19 altère la signalisation de l’interféron de type I [ 238 ], essentielle au bon fonctionnement du système immunitaire. L’interféron intervient dans l’inhibition des cellules tumorales et la régulation de la synthèse protéique dans les cellules immunitaires ; son altération est liée au cancer et aux maladies virales. L’inhibition continue d’IRF9 supprime le ligand inducteur d’apoptose lié au TNF (TRAIL) et tous ses effets régulateurs et apoptotiques. La suppression d’IRF9 devrait également altérer les effets protecteurs du gène BRCA2 contre le cancer et favoriser une forte réponse immunoinflammatoire associée à des maladies neurologiques mortelles [ 239 ]. Les déficits en IRF9 entraînent un risque significativement accru de forme grave de COVID-19 [ 240 ] et altèrent les effets protecteurs de l’activité du gène BRCA2 contre le cancer.
Les cancers associés comprennent les cancers du sein, des trompes de Fallope et de l’ovaire chez la femme, les cancers de la prostate et du sein chez l’homme, ainsi que la leucémie myéloïde aiguë chez l’enfant. Liu et al. [ 241 ] ont montré que les injections d’ARNm suppriment également l’expression d’IRF7 et de STAT2 (protéine 2 de transduction du signal et d’activation de la transcription), ce qui peut interférer avec les effets antitumoraux du gène de prédisposition au cancer du sein 1 (BRCA1). Les cancers associés à BRCA1 sont les cancers du sein, de l’utérus et de l’ovaire chez la femme, les cancers de la prostate et du sein chez l’homme, ainsi qu’un risque modérément accru de cancer du pancréas chez les deux sexes et la leucémie myéloïde aiguë chez l’enfant [ 242 ]. Une expression réduite de BRCA1 est liée à la fois au cancer et à la neurodégénérescence.
7.5. Preuves de la spikeopathie par biopsie et autopsie
Une étude multicentrique allemande portant sur 15 cas suspects de myocardite post-vaccinale contre la COVID-19 (huit Pfizer, deux AstraZeneca et deux Johnson & Johnson) a réalisé un examen immunohistopathologique complet des biopsies endomyocardiques (BEM). Les tests immunologiques de dépistage du SARS-CoV-2 ou d’autres virus associés à l’inflammation myocardique se sont révélés négatifs. Tous les patients, sauf un, présentaient des biomarqueurs inflammatoires et un diagnostic de cardiomyopathie inflammatoire, de myocardite active et de myocardite à cellules géantes sévère. Neuf des quatorze patients étaient positifs à la protéine Spike intramyocardique. L’examen des infiltrats lymphocytaires a révélé une prédominance de lymphocytes CD4+. + , par rapport à CD8 + La présence de lymphocytes T a conduit les auteurs à conclure qu’une réaction auto-immune était à l’origine de la pathologie [ 103 ]. De même, la fréquence relative des lymphocytes activés par HLA-D4 et des macrophages MAC-1+ a été considérée comme un argument en faveur de cette conclusion. La figure 7 illustre quelques colorations tissulaires des protéines de spicule [ 103 ].
L’autopsie d’un homme de 76 ans a révélé que les protéines Spike du vaccin contre la COVID-19 étaient la cause de son décès [ 167 ]. Cliniquement, ce patient présentait des effets indésirables cardiovasculaires dès sa première vaccination (AstraZeneca) en mai 2021, puis des troubles neurologiques et psychiatriques après sa deuxième vaccination (Pfizer) en juillet 2021. Il s’est effondré et est décédé trois semaines après son rappel (Pfizer) en décembre 2021. Des lésions inflammatoires aiguës et chroniques, ainsi qu’une dégénérescence cellulaire, affectaient son cerveau et son cœur. Les analyses immunohistochimiques ont mis en évidence la présence de la protéine Spike dans les parois des vaisseaux sanguins, dans les cellules gliales du cerveau et dans les cellules endothéliales cardiaques présentant une myocardite lymphocytaire [ 167 ] (p. 8). De plus, « la coloration immunohistochimique n’a pas détecté la protéine de la nucléocapside du SARS-CoV-2 », de sorte que l’auteur a conclu : « la présence de la protéine Spike doit être attribuée à la vaccination plutôt qu’à l’infection virale » [ 167 ] (résumé).
Une série de 13 autopsies cérébrales réalisées aux États-Unis a révélé que la sous-unité S1 (incluant le domaine de liaison au récepteur RBD) de la protéine Spike provoquait une dégénérescence des cellules endothéliales neurovasculaires, associée à une endothélite, une libération de cytokines et des lésions des capillaires neuronaux. Les cellules endothéliales contenaient la glycoprotéine Spike, mais pas d’ARN viral, confirmant ainsi que la sous-unité S1/RBD libre de la protéine Spike était le principal agent pathogène dans ces cas de COVID-19, comme illustré sur la figure 8 [ 243 ].
La même équipe de recherche a obtenu des résultats similaires dans une série de 11 autopsies cardiaques de patients décédés de la COVID-19 [ 244 ]. Ils ont noté les détails suivants, suggérant fortement que l’expression de l’antigène Spike étranger était pathologiquement significative :
« Les atteintes cardiaques chez les patients décédés de la COVID-19 sont associées à la protéine Spike virale, mais pas au virus infectieux lui-même. La protéine Spike virale est endocytée par les macrophages interstitiels et induit une myocardite. Les analyses histologiques révèlent un œdème périvasculaire, des lésions des cellules endothéliales et des microthrombi . »
[ 244 ] (points saillants, p. 1)
Les résultats de cette étude menée par un groupe de recherche américain confirment que la spikeopathie est le mécanisme pathogène des atteintes neurovasculaires et cardiaques de la COVID-19. Par conséquent, les gènes largement distribués dans le cerveau et le cœur, via les vaccins contre la COVID-19, et codant pour une production prolongée de la protéine Spike, suivraient probablement les mêmes mécanismes d’action.
Une étude de cas portant sur l’autopsie d’un jeune homme de 22 ans, recrue militaire sud-coréenne en bonne santé jusque-là, a révélé une myocardite étendue cinq jours après la vaccination contre la COVID-19 par le vaccin Pfizer à ARNm. Les auteurs ont souligné l’importance de réaliser des examens histopathologiques lors des autopsies. Ils ont constaté une nette absence de tels examens dans la littérature scientifique durant la pandémie de COVID-19 [ 245 ].
Des pathologistes allemands ont pratiqué une série d’autopsies sur les corps de personnes décédées peu après une vaccination et n’ayant jamais contracté la COVID-19. Le Dr Schirmacher, pathologiste en chef à Heidelberg, et ses collègues ont autopsié 35 personnes décédées à domicile dans les deux semaines suivant une vaccination contre la COVID-19 par ARNm. Dix de ces décès étaient dus à des maladies préexistantes. Parmi les 25 autres décès inattendus, cinq étaient dus à une myocardite, avec des infiltrats inflammatoires lymphocytaires du myocarde et une arythmie présumée associée, en l’absence de toute autre pathologie cardiovasculaire significative. Ces cinq personnes sont décédées dans la semaine suivant la vaccination, dont une dans les 12 heures. Un cas présentait un infiltrat inflammatoire similaire au point d’injection dans le muscle deltoïde [ 246 ].
Un autre groupe de pathologistes allemands, dirigé par le Pr Arne Burkhardt et son collègue le Pr Walter Lang, a présenté les résultats histopathologiques d’une série de 25 autopsies réalisées après vaccination par le vaccin Pfizer contre la COVID-19 à ARNm. Ces résultats ont mis en évidence la présence de protéines de spicule produites par le vaccin dans des lésions des vaisseaux sanguins ainsi que dans des infiltrats inflammatoires de myocardite. La figure 9 , extraite d’une présentation PowerPoint en allemand lors d’un congrès, décrit les protéines de spicule produites par l’ARNm et colorées par immunohistochimie [ 247 ]. Elle montre les protéines de spicule colorées (en brun) infiltrant les cellules endothéliales de la paroi d’un vaisseau sanguin.
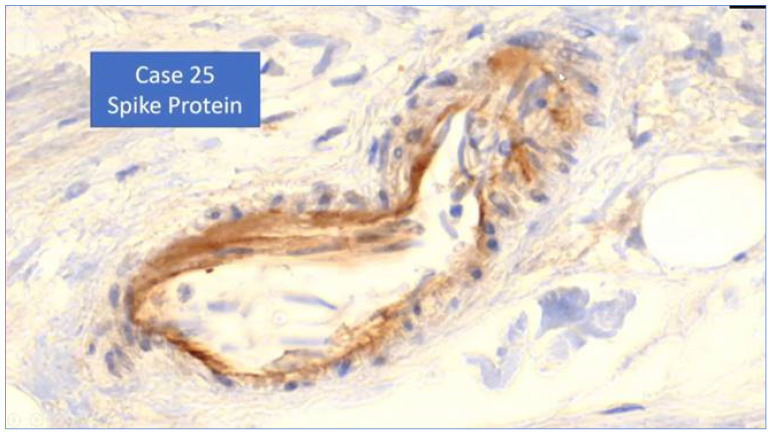
La traduction de l’allemand accompagnant cette diapositive, selon les termes du professeur Arne Burkhardt, est la suivante :
« Oui, c’est le résultat que nous avons pu obtenir grâce à des méthodes spécifiques. Cela signifie que nous sommes absolument certains que, dans ce cas précis, nous pouvons encore détecter cette toxine dans les parois des vaisseaux 122 jours après la vaccination. Il est également clair qu’il s’agit de la cause de ces lésions . »
Ce qui n’est pas clair pour moi en ce moment, c’est si elle est simplement déposée là ou si ces cellules produisent réellement la protéine Spike, comme elles sont censées le faire par l’ARNm, pour ainsi dire .
La figure 10 provient de la même série de cas d’autopsie de Burkhardt et ses collègues, montrant que soit la protéine de pointe a traversé la barrière hémato-encéphalique, soit le complexe lipide-nanoparticule-ARNm l’a fait et a provoqué la transcription des protéines de pointe dans le tissu cérébral [ 248 ].
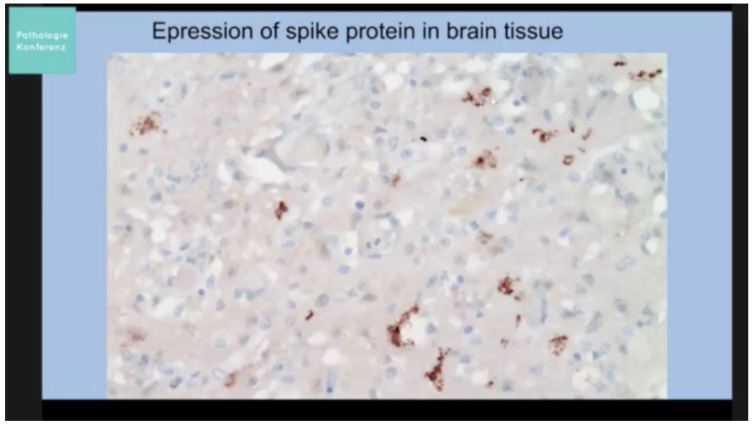
La présence de protéines de spicule dans les tissus pathologiques, ayant contribué au décès de certains patients, pourrait être comparée à la découverte d’une preuve accablante sur une scène de crime, à ceci près que le coup de feu a été tiré, dans certains cas, des mois auparavant. De toute évidence, davantage d’autopsies utilisant ces techniques de coloration et des recherches connexes sont nécessaires.
Une série de cas récente portant sur trois autopsies de patients décédés d’une thrombose veineuse cérébrale induite par des vaccins à ADN adénoviral d’AstraZeneca ou de Janssen/Johnson & Johnson a utilisé la coloration histopathologique des thrombi des sinus veineux cérébraux [ 7 ]. Les auteurs rapportent :
« Les cellules endothéliales adjacentes au thrombus étaient en grande partie détruites. Des marqueurs de piégeage extracellulaire des neutrophiles et d’activation du complément étaient présents à la périphérie et à l’intérieur des thrombi de la veine cérébrale. La protéine Spike du SARS-CoV-2 a été détectée à l’intérieur du thrombus et dans la paroi vasculaire adjacente . »
[ 7 ] (résumé)
Cette découverte de protéines de pointe au niveau des thrombus veineux cérébraux dus aux vaccins COVID-19 à vecteur viral et à ADN, ainsi que la présence de NETose telle que décrite ci-dessus, fournissent une preuve supplémentaire de la spikeopathie due aux vaccins à base de gènes.
8. Discussion
Nous avons débuté cet article en citant la réponse de l’agence australienne de réglementation sanitaire, la TGA, à la question d’un sénateur australien concernant les risques liés aux vaccins génétiques induisant la production de la protéine Spike du SARS-CoV-2 par les cellules humaines. La réponse était que la protéine Spike n’était pas pathogène. Or, nous avons présenté des preuves significatives de sa pathogénicité. Ceci est valable qu’elle soit intégrée au virus, qu’elle soit libre mais d’origine virale, et qu’elle soit produite dans les ribosomes par l’ARNm des vaccins contre la COVID-19 à ARNm et à ADN adénoviral. Les mécanismes physiopathologiques d’action de la protéine Spike sont encore en cours d’élucidation.
Nous avons établi que la protéine Spike induit des lésions en se liant au récepteur ACE2 et en induisant ainsi une diminution de son expression, ce qui endommage les cellules endothéliales vasculaires. La protéine Spike possède un domaine de liaison de type toxine, se liant au récepteur nicotinique α7 (nAChR) dans le système nerveux central et le système immunitaire, interférant ainsi avec les fonctions du nAChR, notamment la réduction de l’inflammation et des cytokines pro-inflammatoires telles que l’IL-6. Le lien avec les maladies neurodégénératives s’explique également par la capacité de la protéine Spike à interagir avec les protéines amyloïdes se liant à l’héparine, initiant ainsi l’agrégation des protéines cérébrales.
La persistance de la protéine Spike provoque une inflammation chronique, susceptible d’induire une tolérance immunitaire (IgG4). Chez la femme et pendant la grossesse, la liaison de la protéine Spike au récepteur alpha des œstrogènes perturbe la signalisation de ces hormones.
La protéine Spike est cytotoxique à l’intérieur des cellules par interaction avec des gènes suppresseurs de tumeurs et endommagement des mitochondries. Les protéines Spike exprimées à la surface des cellules induisent une réponse auto-immune cytopathique.
La protéine Spike libre se lie à l’ACE2 présente sur d’autres cellules des organes et du sang. Dans le sang, elle stimule les plaquettes à libérer des facteurs de coagulation, à sécréter des facteurs inflammatoires et à former des agrégats leucocytes-plaquettes. La protéine Spike se lie également au fibrinogène, induisant la formation de caillots sanguins.
Il existe également une homologie problématique entre la protéine Spike et des protéines clés du système immunitaire adaptatif, ce qui peut entraîner une auto-immunité en cas de vaccination avec l’ARNm produisant la protéine Spike.
Les facteurs pharmacocinétiques contribuent à la physiopathologie. Comme mentionné précédemment, l’étude de biodistribution de Pfizer (où 75 % des molécules vectrices de nanoparticules lipidiques ont quitté le deltoïde pour atteindre tous les organes en 48 h) réalisée pour le compte de la PMDA japonaise était connue de la TGA australienne avant l’autorisation provisoire des vaccins à ARNm contre la COVID-19 pour la population australienne [ 5 ]. Du fait de leur capacité à induire la réplication de la protéine Spike dans de nombreux organes, les vaccins à base de gènes agissent comme des virus synthétiques.
Le vecteur lipidique-nanoparticule de l’ARNm et le PEG associé, qui rend le complexe ARNm-LNP plus stable et résistant à la dégradation, ont leurs propres effets toxiques ; les nanoparticules lipidiques principalement via des effets pro-inflammatoires et le PEG par anaphylaxie chez les individus sensibles.
Röltgen et al. [ 53 ] ont constaté que l’ARNm stabilisé par la N1-méthylpseudouridine dans les vaccins contre la COVID-19 produit des protéines de spicule pendant au moins 60 jours. D’autres recherches citées sur la rétroposition du code génétique [ 249 ] suggèrent la possibilité qu’une telle production d’une protéine pathogène étrangère puisse potentiellement durer toute la vie, voire se transmettre de génération en génération.
De nombreuses études récentes montrent que la protéine Spike elle-même, et en particulier la sous-unité S1, est pathogène et provoque une inflammation ainsi que d’autres pathologies observées dans les formes aiguës sévères de la COVID-19, probablement dans les formes longues, et dans les lésions induites par les vaccins anti-COVID-19 à ARNm et à ADN adénoviral. Le terme « spikeopathie » a été introduit par le chercheur français Henrion-Caude [ 98 ] lors d’une conférence. Compte tenu des effets pathologiques variés et importants de la protéine Spike du SARS-CoV-2, nous suggérons que son utilisation présente un intérêt heuristique.
La spikeopathie exerce ses effets, comme le résument Cosentino et Marino [ 86 ], par l’intermédiaire de la liaison à l’ACE2, induisant une agrégation plaquettaire, une thrombose et une inflammation ; la perturbation des glycoprotéines transmembranaires CD147, qui interfèrent avec la fonction des péricytes cardiaques et des érythrocytes ; la liaison aux TLR2 et TLR4, déclenchant des cascades inflammatoires ; et la liaison aux récepteurs ERα, possiblement responsable d’irrégularités menstruelles et d’une augmentation du risque de cancer via des interactions avec p53BP1 et BRCA1. D’autres recherches mettent en évidence d’autres effets de la spikeopathie via la production de cytokines inflammatoires induite par l’ACE2, la phosphorylation de MEK et la diminution de l’expression d’eNOS, altérant ainsi la fonction des cellules endothéliales.
Les effets particulièrement nouveaux de la protéine Spike impliquent le dérèglement du système cholinergique nicotinique via l’inhibition de l’α7 nAChR, conduisant à une altération des voies biochimiques anti-inflammatoires dans de nombreuses cellules et systèmes d’organes, ainsi qu’à une altération du tonus vagal parasympathique.
Les lésions induites par les vaccins à ARNm et à ADN adénoviral contre la COVID-19 présentent des similitudes avec les formes aiguës sévères de la COVID-19 et la COVID longue, mais sont plus variées, compte tenu de la biodistribution plus large et de la production prolongée de la protéine Spike. La myopéricardite est reconnue, mais a souvent été minimisée, considérée comme bénigne et rare. Pourtant, les données probantes concernant la myopéricardite subclinique relativement fréquente associée au vaccin contre la COVID-19 [ 113 , 115 ] et les données d’autopsie [ 246 , 247 , 248 ] suggèrent un rôle dans les décès subits chez des personnes relativement jeunes et en bonne santé [ 116 , 117 ]. Les protéines Spike ont également des mécanismes pour augmenter la thrombose via l’inflammation liée à l’ACE-2, la perturbation du système angiotensine [ 119 ], la liaison directe avec les récepteurs ACE-2 sur les plaquettes [ 1 ], la perturbation de l’antithrombine [ 122 ], le retardement de la fibrinolyse [ 123 ] (prépublication) et la réduction de la répulsion électrostatique des érythrocytes conduisant à l’hémagglutination [ 124 ].
Les nouvelles maladies auto-immunes d’apparition après la vaccination contre la COVID-19 pourraient être liées à l’homologie de la protéine Spike et, dans la maladie virale, à d’autres protéines du SARS-CoV-2, avec des protéines humaines [ 5 , 138 ].
Le complexe ARNm-LNP traverse la barrière hémato-encéphalique (BHE) et les troubles neurologiques sont fréquemment rapportés dans les bases de données de pharmacovigilance après la vaccination contre la COVID-19. Plusieurs mécanismes de la spikeopathie sont en cours d’élucidation comme troubles sous-jacents impliquant : la perméabilité de la BHE [ 128 ] ; une altération mitochondriale [ 168 ] ; une dérégulation des péricytes vasculaires cérébraux [ 169 ] ; une neuroinflammation médiée par TLR4 [ 170 ] ; la mort cellulaire hippocampique [ 171 ] ; une dérégulation des cascades du complément et de la coagulation et des neutrophiles provoquant des coagulopathies [ 173 ] (prépublication) ; une neuroinflammation et une démyélinisation via une dérégulation microgliale [ 174 , 177 , 180 ] ; une expression accrue d’α-synucléine impliquée dans les maladies neurodégénératives [ 175 ] ; des taux élevés de chimiokine à motif CC 11 associés au vieillissement et à la perte subséquente de cellules neuronales et de myéline. se liant au récepteur nicotinique de l’acétylcholine α7 (nAChR), augmentant les niveaux d’IL-1b et de TNF α dans le cerveau, ce qui provoque des niveaux élevés d’inflammation [ 172 , 177 ] ; la sous-unité S1 est amyloïdogène [ 185 ] ; dysautonomie [ 96 ], soit par lésion neuronale directe, soit par mécanismes indirects à médiation immunitaire, par exemple l’inhibition de l’α7 nAChR ; l’anosmie causée à la fois par le vaccin et la maladie [ 44 ], également prodromique de la maladie de Parkinson.
De plus, les auto-anticorps dans le domaine C-terminal globulaire peuvent provoquer la maladie de Creutzfeldt-Jakob (MCJ) [ 218 ], le miR-146a est altéré en association avec la COVID-19 [ 222 ] et associé à la fois à l’infection virale et aux maladies à prions dans le cerveau, et il a été démontré que S1 induit la sénescence dans les cellules transfectées.
Le nombre de mécanismes possibles de lésions cérébrales induites par les potentiels d’action est à l’image de la prévalence des effets indésirables neurologiques et neurodégénératifs dans la réalité, et nécessite de toute urgence des recherches supplémentaires.
Le cancer, bien qu’il ne soit pas formellement prouvé qu’il soit causé par les vaccins, semble suivre de près la vaccination, et nous avons examiné les causes possibles sous la forme d’interactions entre la protéine Spike et les facteurs de transcription et les gènes suppresseurs de cancer.
Le vaccin était destiné à protéger les personnes de plus de 60 ans présentant le plus grand risque de mortalité due à la COVID-19 [ 10 ], mais une analyse des risques réalisée par Dopp et Seneff (2022) [ 250 ] a montré que la probabilité de mourir de l’injection n’est que de 0,13 % inférieure au risque de mourir de l’infection chez les personnes âgées de plus de 80 ans.
De plus, le vieillissement naturel s’accompagne de modifications du système immunitaire qui compromettent la capacité à répondre efficacement aux nouveaux antigènes. À l’instar des réponses immunitaires aux virus qui varient selon l’âge, les vaccins deviennent moins efficaces pour induire une immunité chez les personnes âgées, ce qui réduit leur capacité à lutter contre les nouvelles infections [ 251 ]. La vaccination à deux doses contre la COVID-19 par ARNm a conféré une réponse immunitaire adaptative limitée chez les souris âgées, les rendant sensibles à l’infection par le SARS-CoV-2 [ 252 ]. Le risque de forme grave de la maladie chez les vétérans américains après vaccination est resté associé à l’âge, selon une étude de Vo et al. (2022) [ 253 ]. Ce risque d’infections malgré la vaccination était également plus élevé en présence d’immunodéficience.
Enfin, nous avons examiné les meilleures séries de cas d’autopsie actuellement disponibles, réalisées en Allemagne, qui établissent les liens entre la spikeopathie et les défaillances multi-organiques, les neuropathies et la mort.
9. Conclusions
Dans cette revue narrative, nous avons établi le rôle pathogène de la protéine Spike du SARS-CoV-2, et plus particulièrement de sa sous-unité S1. Il est désormais également évident que les protéines Spike, largement biodistribuées et produites par les gènes codant pour l’ARNm et l’ADN adénoviral, induisent une grande variété de maladies. Les mécanismes physiopathologiques et biochimiques sous-jacents sont en cours d’élucidation. Les nanoparticules lipidiques utilisées comme vecteurs pour les vaccins à ARNm et Novavax présentent également des propriétés pro-inflammatoires pathologiques. Le principe même des vaccins géniques produisant des antigènes étrangers dans les tissus humains comporte des risques importants de maladies auto-immunes et inflammatoires, notamment lorsque leur distribution n’est pas très localisée.
Les implications cliniques qui en découlent sont les suivantes : les cliniciens de toutes les spécialités médicales doivent être attentifs aux diverses manifestations possibles de la maladie liée au vaccin contre la COVID-19, qu’elles soient aiguës ou chroniques, et à l’aggravation de pathologies préexistantes. Nous préconisons également la suspension des vaccins contre la COVID-19 à base de gènes et de matrices lipidiques-nanoparticulaires, ainsi que des autres vaccins utilisant la technologie de l’ARNm ou de l’ADN vecteur viral. Il est plus sûr d’utiliser des vaccins utilisant des technologies éprouvées à base de protéines recombinantes, de virus atténués ou inactivés, dont il existe aujourd’hui de nombreuses options pour la vaccination contre le SARS-CoV-2.
Contributions des auteurs
Conceptualisation : PIP, AL, CT et JG ; rédaction – première ébauche : PIP, AL, CT, CJN, RC et JG ; rédaction – révision et correction : PIP, CJN, AL, CT, NJH, JG et RC. Tous les auteurs ont lu et approuvé la version publiée du manuscrit.
Déclaration de disponibilité des données
Les données utilisées dans la figure 1 proviennent des données officielles de NSW Health figurant dans le tableau du rapport de NSW Health présenté dans la figure 2 .
Conflits d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts.
Déclaration de financement
Cette recherche n’a bénéficié d’aucun financement externe.
Notes de bas de page
Avertissement/Note de l’éditeur : Les déclarations, opinions et données contenues dans toutes les publications sont celles de leurs auteurs et contributeurs respectifs et n’engagent en aucun cas la responsabilité de MDPI ni des éditeurs. MDPI et/ou les éditeurs déclinent toute responsabilité en cas de dommages corporels ou matériels résultant des idées, méthodes, instructions ou produits mentionnés dans le contenu.
Références
- 1. Zhang S., Liu Y., Wang X., Yang L., Li H., Wang Y., Liu M., Zhao X., Xie Y., Yang Y., et al. Le SARS-CoV-2 se lie à l’ACE2 plaquettaire et favorise la thrombose chez les patients atteints de COVID-19. J. Hematol. Oncol. 2020;13:120. doi: 10.1186/s13045-020-00954-7. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 2. Solis O., Beccari AR, Iaconis D., Talarico C., Ruiz-Bedoya CA, Nwachukwu JC, Cimini A., Castelli V., Bertini R., Montopoli M. et al. La protéine de pointe du SRAS-CoV-2 se lie et module les récepteurs des œstrogènes. Ski. Av. 2022 ; 8 : eadd4150. est ce que je: 10.1126/sciadv.add4150. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- [ Article gratuit PMC ] [ PubMed ] [ Cross Ref ] 3. Kiaie SH, Majidi Zolbanin N, Ahmadi A, Bagherifar R, Valizadeh H, Kashanchi F, Jafari R. Progrès récents dans la thérapeutique ARNm-LNP : aspects immunologiques et pharmacologiques. J. Nanobiotechnologie. Rév.2022;20:2 est ce que je : 10.1186/s12951-022-01478-7. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar
- 4. Kariko K., Muramatsu H., Welsh FA, Ludwig J., Kato H., Akira S., Weissman D. L’incorporation de pseudouridine dans l’ARNm permet d’obtenir un vecteur non immunogène de qualité supérieure, présentant une capacité de traduction et une stabilité biologique accrues. Mol. Ther. 2008;16:1833–1840. doi: 10.1038/mt.2008.200. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 5. Administration des produits thérapeutiques (TGA), réponse à la demande d’accès à l’information n° 2389-6, p. 45. Rapport d’évaluation non clinique : vaccin BNT162b2 [ARNm] contre la COVID-19 (COMIRNATYTM). Numéro de soumission : PM-2020-05461-1-2. Promoteur : Pfizer Australia Pty Ltd. Ministère australien de la Santé et des Soins aux personnes âgées : 2021 ; réponse à la demande d’accès à l’information n° 2389-6. [(consulté le 7 avril 2023)] ; Disponible en ligne : https://www.tga.gov.au/sites/default/files/foi-2389-06.pdf .
- 6. AstraZeneca 2.4 Aperçu non clinique AZD1222 : Doc ID-004493554 ; MHRA : 2022-10-24-IR0751D 2021. [(consulté le 12 juillet 2023)]. Disponible en ligne : https://icandecide.org/wp-content/uploads/2022/11/2022-10-24-IR0751D_Production_MHRA_000001-000166-166-pages.pdf .
- 7. Geeraerts T., Guilbeau-Frugier C., Garcia C., Memier V., Raposo N., Bonneville F., Gales C., Darcourt J., Voisin S., Ribes A., et al. Caractéristiques immunohistologiques de la thrombose veineuse cérébrale due à une thrombocytopénie thrombotique immunologique induite par la vaccination. Neurol. Neuroimmunol. Neuroinflamm. 2023;10:e200127. doi: 10.1212/NXI.0000000000200127. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 8. Lyons-Weiler J. L’amorçage pathogène contribue probablement à la gravité et à la mortalité des cas de COVID-19 par le biais de l’auto-immunité. J. Transl. Autoimmun. 2020;3:100051. doi : 10.1016/j.jtauto.2020.100051. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 9. Vojdani A., Vojdani E., Kharrazian D. Réaction des anticorps monoclonaux humains dirigés contre les protéines du SARS-CoV-2 avec les antigènes tissulaires : implications pour les maladies auto-immunes. Front. Immunol. 2021 ;11 :617089. doi : 10.3389/fimmu.2020.617089. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 10. Reyna-Villasmil E., Caponcello MG, Maldonado N., Olivares P., Caroccia N., Bonazzetti C., Tazza B., Carrara E., Giannella M., Tacconelli E., et al. Association des caractéristiques épidémiologiques et des comorbidités des patients avec la gravité et le risque de mortalité associé à l’infection par le SARS-CoV-2 : résultats d’une revue systématique et d’une méta-analyse. Biomedicines. 2022 ;10 :2437. doi : 10.3390/biomedicines10102437. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 11. Verity R., Okell LC, Dorigatti I., Winskill P., Whittaker C., Imai N., Cuomo-Dannenburg G., Thompson H., Walker PGT, Fu H., et al. Estimation de la gravité de la maladie à coronavirus 2019 : une analyse basée sur un modèle. Lancet Infect. Dis. 2020 ;20 :669-677. doi : 10.1016/S1473-3099(20)30243-7. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 12. Polack FP, Thomas SJ, Kitchin N., Absalon J., Gurtman A., Lockhart S., Perez JL, Pérez Marc G., Moreira ED, Zerbini C., et al. Sécurité et efficacité du vaccin anti-Covid-19 à ARNm BNT162b2. N. Engl. J. Med. 2020;383:2603–2615. doi : 10.1056/NEJMoa2034577. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 13. Vérification des faits de l’université RMIT : Pfizer a-t-il fait un aveu « scandaleux » au Parlement européen concernant son vaccin contre la COVID-19 ? ABC News. 2022. [(consulté le 6 juillet 2023)]. Disponible en ligne : https://abc.net.au/news/2022-10-21/fact-check-pfizer-admission-transmission-european-parliament/101556606 .
- 14. Watson OJ, Barnsley G., Toor J., Hogan AB, Winskill P., Ghani AC. Impact mondial de la première année de vaccination contre la COVID-19 : une étude de modélisation mathématique. Lancet Infect. Dis. 2022 ;22 :1293-1302. doi : 10.1016/S1473-3099(22)00320-6. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 15. Roussel Y., Giraud-Gatineau A., Jimeno MT, Rolain JM, Zandotti C., Colson P., Raoult D. SARS-CoV-2 : Peur ou données ? Int. J. Antimicrob. Agents. 2020 ;55 :105947. doi : 10.1016/j.ijantimicag.2020.105947. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 16. Ioannidis JPA, Cripps S., Tanner MA. Les prévisions concernant la COVID-19 ont échoué. Int. J. Forecast. 2022;38:423–438. doi : 10.1016/j.ijforecast.2020.08.004. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 17. Rid A., Lipsitch M., Miller FG. L’éthique du maintien du placebo dans les essais de vaccins contre le SARS-CoV-2. JAMA. 2021;325:219–220. doi : 10.1001/jama.2020.25053. [ DOI ] [ PubMed ] [ Google Scholar ]
- 18. Groupe d’experts ad hoc de l’OMS sur les prochaines étapes de l’évaluation de la COVID-19. Krause PR, Fleming TR, Longini IM, Peto R., Beral V., Bhargava B., Cravioto A., Cramer JP, Ellenberg SS, et al. Essais contrôlés par placebo des vaccins contre la COVID-19 : pourquoi nous en avons encore besoin. N. Engl. J. Med. 2021 ;384 :e2. doi : 10.1056/NEJMp2033538. [ DOI ] [ PubMed ] [ Google Scholar ]
- 19. Groupe de contrôle coopératif. Étude sur le vaccin contre la Covid. 2021. [(consulté le 3 juillet 2023)]. Disponible en ligne : https://www.vcgwiki.com/the-covid-vaccine-study .
- 20. Verkerk R., Kathrada N., Plothe C., Lindley K. Une cohorte de personnes s’étant auto-sélectionnées comme « non vaccinées » contre la COVID-19 rapporte des résultats de santé favorables et une discrimination injustifiée dans une enquête mondiale. Int. J. Vaccine Theory Pract. Res. 2022;2:321–354. doi: 10.56098/ijvtpr.v2i2.43. [ DOI ] [ Google Scholar ]
- 21. NSW Health NSW Respiratory Surveillance Report—Week Ending 31 December 2022. [(accessed on 10 July 2023)];2022 Available online: https://www.health.nsw.gov.au/Infectious/covid-19/Documents/weekly-covid-overview-20221231.pdf .
- 22. Statut réglementaire des vaccins contre la COVID-19 de l’Administration des produits thérapeutiques (TGA). Ministère australien de la Santé et des Soins aux personnes âgées : Tga.gov.au. [(consulté le 7 avril 2023)] ; 2023. Disponible en ligne : https://www.tga.gov.au/products/covid-19/covid-19-vaccines/covid-19-vaccine-provisional-registrations .
- 23. Administration des produits thérapeutiques (TGA) La TGA approuve provisoirement le vaccin contre la COVID-19 Novavax (Biocelect Pty Ltd) NUVAXOVID. Ministère australien de la Santé et des Soins aux personnes âgées : Tga.gov.au. [(consulté le 7 avril 2023)] ; 2023 Disponible en ligne : https://www.tga.gov.au/news/media-releases/tga-provisionally-approves-novavax-biocelect-pty-ltds-covid-19-vaccine-nuvaxovid .
- 24. Comité sénatorial : Commission des affaires communautaires. Réponses aux questions posées, résultat 1 — Politique de santé, accès et soutien, prévisions budgétaires 2022-2023, octobre et novembre. Parlement fédéral australien ; Canberra, Australie : 2022. [ Google Scholar ]
- 25. Kuba K., Imai Y., Rao S., Gao H., Guo F., Guan B., Huan Y., Yang P., Zhang Y., Deng W. et al. Un rôle crucial de l’enzyme de conversion de l’angiotensine 2 (ACE2) dans les lésions pulmonaires induites par le coronavirus du SRAS. Nat. Méd. 2005 ; 11 : 875-879. est ce que je : 10.1038/nm1267. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar
- 26. Wrapp D., Wang N., Corbett KS, Goldsmith JA, Hsieh CL, Abiona O., Graham BS, McLellan JS. Structure cryo-EM de la protéine Spike du 2019-nCoV en conformation de préfusion. Science. 2020;367:1260–1263. doi: 10.1126/science.abb2507. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 27. Cuffari B. Que sont les protéines Spike ? News-Medical.Net. 2021. [(consulté le 26 avril 2023)]. Disponible en ligne : https://www.news-medical.net/health/What-are-Spike-Proteins.aspx .
- 28. Carnell GW, Ciazynska KA, Wells DA, Xiong X., Aguinam ET, McLaughlin SH, Mallery D., Ebrahimi S., Ceron-Gutierrez L., Asbach B., et al. La protéine Spike du SARS-CoV-2 stabilisée à l’état fermé induit de puissantes réponses neutralisantes. J. Virol. 2021;95:e0020321. doi: 10.1128/JVI.00203-21. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 29. Seneff S., Kyriakopoulos AM, Nigh G., McCullough PA. Rôle potentiel de la protéine Spike dans les maladies neurodégénératives : une revue narrative. Cureus. 2023 ;15 :e34872. doi : 10.7759/cureus.34872. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 30. Changeux JP, Amoura Z., Rey FA, Miyara M. Une hypothèse nicotinique pour la Covid-19 : implications préventives et thérapeutiques. Comptes Rendus Biol. 2020 ;343 :33-39. doi : 10.5802/crbiol.8. [ DOI ] [ PubMed ] [ Google Scholar ]
- 31. Nirthanan S. Neurotoxines α à trois doigts de serpent et récepteurs nicotiniques de l’acétylcholine : molécules, mécanismes et applications thérapeutiques. Biochem. Pharmacol. 2020 ;181 :114168. doi : 10.1016/j.bcp.2020.114168. [ DOI ] [ PubMed ] [ Google Scholar ]
- 32. Farsalinos K., Niaura R., Le Houezec J., Barbouni A., Tsatsakis A., Kouretas D., Vantarakis A., Poulas K. Éditorial : Nicotine et SARS-CoV-2 : la COVID-19 pourrait être une maladie du système cholinergique nicotinique. Toxicol. Rep. 2020 ;7 :658-663. doi : 10.1016/j.toxrep.2020.04.012. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 33. O’Brien BCV, Weber L., Hueffer K., Weltzin MM. L’ectodomaine de la protéine Spike du SARS-CoV-2 cible les récepteurs nicotiniques de l’acétylcholine α7. J. Biol. Chem. 2023;299:104707. doi : 10.1016/j.jbc.2023.104707. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 34. ACROBiosystems. Aperçu des différents vaccins contre la COVID-19. ACROBiosystems Insights, 2021. Aperçu des différents vaccins contre la COVID-19 — ACROBiosystems. [(consulté le 7 avril 2023)]. Disponible en ligne : https://www.acrobiosystems.com/A1374-An-Overview-of-Different-COVID-19-Vaccines.html .
- 35. Liste des autorisations de vaccins contre la COVID-19 (Wikipedia). 2023. [(consulté le 7 avril 2023)]. Disponible en ligne : https://en.wikipedia.org/wiki/List_of_COVID-19_vaccine_authorizations .
- 36. Agence américaine des produits alimentaires et médicamenteux (FDA). Communiqué de presse de la FDA : La FDA approuve une thérapie ciblée à base d’ARN, une première en son genre, pour traiter une maladie rare. Salle de presse de la FDA, FDA.gov.au. [(consulté le 7 avril 2023)] ; 2018. Disponible en ligne : https://www.fda.gov/news-events/press-announcements/fda-approves-first-its-kind-targeted-rna-based-therapy-treat-rare-disease .
- 37. Dolgin E. L’histoire complexe des vaccins à ARNm. Nature. 2021;597:318–324. doi : 10.1038/d41586-021-02483-w. [ DOI ] [ PubMed ] [ Google Scholar ]
- 38. McCann N., O’Connor D., Lambe T., Pollard AJ. Vaccins à vecteur viral. Curr. Opin. Immunol. 2022;77:102210. doi : 10.1016/j.coi.2022.102210. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 39. Altman PM, Rowe J., Hoy W., Brady G., Lefringhausen A., Cosford R., Wauchope B. Les impératifs de sécurité nationale ont-ils compromis la sécurité du vaccin contre la COVID-19 ? Trial Site News. 2022. [(consulté le 9 juin 2023)]. Disponible en ligne : https://www.trialsitenews.com/a/did-national-security-imperatives-compromise-covid-19-vaccine-safety-adfea242 .
- 40. Lalani HS, Nagar S., Sarpatwari A., Barenie RE, Avorn J., Rome BN, Kesselheim AS. Investissement public américain dans le développement de vaccins à ARNm contre la COVID-19 : étude de cohorte rétrospective. BMJ. 2023 ; 380 : e073747. doi : 10.1136/bmj-2022-073747. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 41. McCullough P. La longue, coûteuse et mortelle histoire d’amour de l’Amérique avec l’ARNm. Dans Courageous Discourse, Substack.com : 2023. [(consulté le 15 mars 2023)]. Disponible en ligne : https://petermcculloughmd.substack.com/p/americas-long-expensive-and-deadly .
- 42. Turni C., Lefringhausen A. Vaccins contre la Covid-19 : une revue australienne. J. Clin. Exp. Immunol. 2022;7:491–508. [ Google Scholar ]
- 43. Ndeupen S., Qin Z., Jacobsen S., Bouteau A., Estanbouli H., Igyártó BZ. Le composant nanoparticulaire lipidique de la plateforme mRNA-LNP utilisé dans les études précliniques de vaccins est fortement inflammatoire. iScience. 2021;24:103479. doi: 10.1016/j.isci.2021.103479. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 44. Wick P., Malek A., Manser P., Meili D., Maeder-Althaus X., Diener L., Diener PA, Zisch A., Krug HF, von Mandach U. Capacité de barrière du placenta humain aux nanomatériaux. Environ. Health Perspect. 2010;118:432–436. doi: 10.1289/ehp.0901200. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 45. Zhou Y., Peng Z., Seven ES, Leblanc RM. Passage de la barrière hémato-encéphalique par des nanoparticules. J. Control Release. 2018;270:290–303. doi : 10.1016/j.jconrel.2017.12.015. [ DOI ] [ PubMed ] [ Google Scholar ]
- 46. Agence japonaise des produits pharmaceutiques et des dispositifs médicaux (PMDA) Vaccin à ARNm contre le SARS-CoV-2 (BNT162, PF-07302048) 2021. [(consulté le 7 avril 2023)]. Disponible en ligne : https://www.pmda.go.jp/drugs/2021/P20210212001/672212000_30300AMX00231_I100_1.pdf .
- 47. Judicial Watch. Une étude Pfizer/BioNTech a révélé la présence de nanoparticules lipidiques en dehors du site d’injection chez les animaux testés. judicialwatch.org. 2022. [Consulté le 12 juillet 2023]. Disponible en ligne : https://www.judicialwatch.org/nanoparticles-materials-outside-injection-site/
- 48. Di J., Du Z., Wu K., Jin S., Wang X., Li T., Xu Y. Biodistribution et expression génique non linéaire des LNP d’ARNm : influence de la voie d’administration et de la taille des particules. Pharm. Res. 2022 ;39 :105-114. doi : 10.1007/s11095-022-03166-5. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 49. Morais P., Adachi H., Yu YT. Contribution essentielle de la pseudouridine aux vaccins à ARNm contre la COVID-19. Front. Cell. Dev. Biol. 2021;9:789427. doi : 10.3389/fcell.2021.789427. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 50. Fertig TE, Chitoiu L., Marta DS, Ionescu VS, Cismasiu VB, Radu E., Angheluta G., Dobre M., Serbanescu A., Hinescu ME, et al. L’ARNm du vaccin peut être détecté dans le sang 15 jours après la vaccination. Biomédicaments. 2022;10:1538. est ce que je: 10.3390/biomedicines10071538. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 51. Castruita JAS, Schneider UV, Mollerup S., Leineweber TD, Weis N., Bukh J., Pedersen MS, Westh H. Les séquences d’ARNm du vaccin Spike du SARS-CoV-2 circulent dans le sang jusqu’à 28 jours après la vaccination contre la COVID-19. APMIS. 2023;131:128–132. doi : 10.1111/apm.13294. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 52. Ogata AF, Cheng C.-A., Desjardins M., Senussi Y., Sherman AC, Powell M., Novack L., Von S., Li X., Baden LR, et al. Antigène vaccinal circulant contre le coronavirus 2 du syndrome respiratoire aigu sévère (SARS-CoV-2) détecté dans le plasma des personnes vaccinées avec le vaccin mRNA-1273. Clin. Infect. Dis. 2021;74:715–718. doi: 10.1093/cid/ciab465. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 53. Röltgen K., Nielsen SCA, Silva O., Younes SF, Zaslavsky M., Costales C., Yang F., Wirz OF, Solis D., Hoh RA, et al. Empreinte immunitaire, étendue de la reconnaissance des variants et réponse des centres germinatifs lors de l’infection et de la vaccination contre le SARS-CoV-2 chez l’humain. Cell. 2022;185:1025–1040.e14. doi: 10.1016/j.cell.2022.01.018. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 54. Yonker LM, Swank Z., Bartsch YC, Burns MD, Kane A., Boribong BP, Davis JP, Loiselle M., Novak T., Senussi Y., et al. Détection de la protéine Spike circulante dans la myocardite post-vaccinale à ARNm contre la COVID-19. Circulation. 2023;147:867–876. doi : 10.1161/CIRCULATIONAHA.122.061025. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 55. Jikomes N. Pseudouridine, vaccins à ARNm et persistance de la protéine Spike. Dans Mind & Matter avec Nick Jikomes, mindandmatter.substack.com. 2022. [(consulté le 7 avril 2023)]. Disponible en ligne : https://mindandmatter.substack.com/p/pseudouridine-mrna-vaccines-and-spike .
- 56. Yong SJ. Un vaccin à ARNm reste actif dans l’organisme plus longtemps que prévu, selon de nouvelles données. Mais il n’est pas dangereux. Dans Microbial Instincts, Medium.com. 2022. [(consulté le 7 avril 2023)]. Disponible en ligne : https://medium.com/microbial-instincts/mrna-vaccine-stays-active-in-the-body-longer-than-expected-new-data-shows-but-it-isnt-harmful-aaa40544bc06 .
- 57. Bansal S., Perincheri S., Fleming T., Poulson C., Brian T., Bremner MR, Mohanakumar T. À la pointe de la recherche : la vaccination par le vaccin BNT162b2 (Pfizer–BioNTech) induit la production d’exosomes circulants contenant la protéine Spike du SARS-CoV-2 avant l’apparition des anticorps : un nouveau mécanisme d’activation immunitaire par les vaccins à ARNm. J. Immunol. 2021 ; 207 : 2405-2410. doi : 10.4049/jimmunol.2100637. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 58. Yamamoto M., Kase M., Sano H., Kamijima R., Sano S. Une infection persistante par le virus varicelle-zona après vaccination contre la COVID-19 par ARNm était associée à la présence de la protéine Spike codée dans la lésion. J. Cutan. Immunol. Allergy. 2023;6:18–23. doi: 10.1002/cia2.12278. [ DOI ] [ Google Scholar ]
- 59. Maugeri M., Nawaz M., Papadimitriou A. Lien entre l’échappement endosomal de l’ARNm-LNP et son chargement dans les vésicules extracellulaires pour le transport vers d’autres cellules. Nat. Commun. 2019;10:4333. doi: 10.1038/s41467-019-12275-6. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 60. Wang R., Huang K. CCL11 augmente la proportion de cellules Treg CD4+CD25+Foxp3+ et la production d’IL-2 et de TGF-β par les lymphocytes T CD4+ via la voie de signalisation STAT5. Mol. Med. Rep. 2020;21:2522–2532. doi: 10.3892/mmr.2020.11049. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 61. Segalla G. Criticité physico-chimique et potentiel toxicologique des nanomatériaux lipidiques contenus dans un vaccin à ARNm contre la COVID-19. Int. J. Vaccine Theory Pract. Res. Inj. Causes Treat. 2023;3:787–817. doi: 10.56098/ijvtpr.v3i1.68. [ DOI ] [ Google Scholar ]
- 62. Question parlementaire P-005690/2021 du Parlement européen : Excipients ALC-0315 et ALC-0159. Question prioritaire pour réponse écrite à la Commission, article 138, Guido Reil (ID) ; Parlement européen, Europarl.europa.eu, 2021. [Consulté le 4 juin 2023]. Disponible en ligne : https://www.europarl.europa.eu/doceo/document/P-9-2021-005690_EN.html .
- 63. Bushmanova SV, Ivanov AO, Buyevich YU. Physica A : Mécanique statistique et ses applications. Volume 202. Elsevier ; Amsterdam, Pays-Bas : 1994. L’effet d’un électrolyte sur la séparation de phases dans les colloïdes ; p. 175-195. [ Google Scholar ]
- 64. Poon W., Zhang YN, Ouyang B., Kingston BR, Wu JLY, Wilhelm S., Chan WCW. Voies d’élimination des nanoparticules. ACS Nano. 2019;13:5785–5798. doi: 10.1021/acsnano.9b01383. [ DOI ] [ PubMed ] [ Google Scholar ]
- [ Article gratuit PMC ] [ PubMed ] 65. Trougakos IP, Terpos E, Alexopoulos H, Politou M, Paraskevis D, Scorilas A, Kastritis E, Andreakos E, Dimopoulos MA Effets indésirables induits par le vaccin à ARNm COVID-19 : dénouer les inconnues. Tendances Mol. Méd. Rév. 2022 ; 28 : 800-802. est ce que je : 10.1016/j.molmed.2022.07.008. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar
- 66. Halma MT, Rose J., Lawrie T. Nouveauté des vaccins viraux à ARNm et risques potentiels : une revue exploratoire. J. 2023 ;6 :220-235. doi : 10.3390/j6020017. [ DOI ] [ Google Scholar ]
- 67. Yamamoto K. Effets indésirables des vaccins contre la Covid-19 et mesures de prévention. Virol. J. 2022;19:100. doi : 10.1186/s12985-022-01831-0. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 68. Sahin U., Oehm P., Derhovanessian E., Jabulowsky RA, Vormehr M., Gold M., Maurus D., Schwarck-Kokarakis D., Kuhn AN, Omokoko T., et al. Un vaccin à ARN induit une immunité dans le mélanome traité par inhibiteurs de points de contrôle immunitaire. Nature. 2020;585:107–112. doi: 10.1038/s41586-020-2537-9. [ DOI ] [ PubMed ] [ Google Scholar ]
- 69. Doener F., Hong HS, Meyer I., Tadjalli-Mehr K., Daehling A., Heidenreich R., Koch SD, Fotin-Mleczek M., Gnad-Vogt U. L’adjuvant à base d’ARN CV8102 améliore l’immunogénicité d’un vaccin antirabique homologué lors d’un premier essai chez l’humain. Vaccine. 2019;37:1819–1826. doi: 10.1016/j.vaccine.2019.02.024. [ DOI ] [ PubMed ] [ Google Scholar ]
- 70. Anttila V., Saraste A., Knuuti J., Jaakkola P., Hedman M., Svedlund S., Lagerström-Fermér M., Kjaer M., Jeppsson A., Gan LM. ARNm synthétique codant pour le VEGF-A chez des patients subissant un pontage aorto-coronarien : conception d’un essai clinique de phase 2a. Mol. Ther. Methods Clin. Dev. 2020 ;18 :464-472. doi : 10.1016/j.omtm.2020.05.030. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 71. Crescioli S., Correa I., Karagiannis P., Davies AM, Sutton BJ, Nestle FO, Karagiannis SN. Caractéristiques et fonctions des IgG4 dans l’immunité anticancéreuse. Curr. Allergy Asthma Rep. 2016;16:7. doi: 10.1007/s11882-015-0580-7. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 72. Schlaudecker EP, McNeal MM, Dodd CN, Ranz JB, Steinhoff MC. La grossesse modifie la réponse immunitaire à la vaccination antigrippale trivalente. J. Infect. Dis. 2012;206:1670–1673. doi: 10.1093/infdis/jis592. [ DOI ] [ PubMed ] [ Google Scholar ]
- 73. Zhang X., Lu H., Peng L., Zhou J., Wang M., Li J., Liu Z., Zhang W., Zhao Y., Zeng X., et al. Rôle de PD-1/PD-L dans la pathogenèse des maladies liées aux IgG4. Rheumatology. 2022;61:815–825. doi : 10.1093/rheumatology/keab360. [ DOI ] [ PubMed ] [ Google Scholar ]
- 74. Communication d’alerte de Medsafe : Des cas de myocardite et de péricardite ont été signalés avec Nuvaxovid (vaccin Novavax contre la COVID-19). Autorité néo-zélandaise de sécurité des médicaments et des dispositifs médicaux : Medsafe.govt.nz. [(consulté le 7 avril 2023)] ; 2022 Disponible en ligne : https://www.medsafe.govt.nz/safety/Alerts/nuvaxovid-myocarditis.asp .
- 75. AstraZeneca 2.4 Aperçu non clinique AZD1222 : Doc ID-004365565 ; MHRA : 2022-10-24-IR0751D 2020. [(consulté le 12 juillet 2023)]. Disponible en ligne : https://icandecide.org/wp-content/uploads/2022/11/2022-10-24-IR0751D_Production_MHRA_000001-000166-166-pages.pdf .
- 76. Biotech B. Covaxin — Premier vaccin indien contre la COVID-19. 2022. [(consulté le 8 avril 2023)]. Disponible en ligne : https://www.bharatbiotech.com/covaxin.html .
- 77. Sinovac – Présentation du CoronaVac. 2021. [(consulté le 8 avril 2023)]. Disponible en ligne : http://www.coronavac.cn/
- 78. Projet Vaxine COVID-19. 2022. [(consulté le 11 juin 2023)]. Disponible en ligne : https://vaxine.net/projects/
- 79. CinnaGen SpikoGen : Vaccin recombinant contre la COVID-19. 2022. [(consulté le 11 juin 2023)]. Disponible en ligne : https://www.cinnagen.com/Product.aspx?t=2&l=1&Id=607 .
- [ PubMed ] 80. Tabarsi P., Anjidani N., Shahpari R., Mardani M., Sabzvari A., Yazdani B., Roshanzamir K., Bayatani B., Taheri A., Petrovsky N., et al. Sécurité et immunogénicité de SpikoGen®, un vaccin à protéine de pointe du SRAS-CoV-2 avec adjuvant Advax-CpG55.2 : un essai randomisé de phase 2 contrôlé par placebo dans des populations séropositives et séronégatives. Clin. Microbiol. Infecter. 2022 ; 28 : 1263-1271. est ce que je : 10.1016/j.cmi.2022.04.004. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar
- 81. Tabarsi P., Anjidani N., Shahpari R., Roshanzamir K., Fallah N., Andre G., Petrovsky N., Barati S. Immunogénicité et innocuité de SpikoGen®, un vaccin recombinant contre la protéine Spike du SARS-CoV-2 avec adjuvant, utilisé comme rappel vaccinal homologue et hétérologue : essai randomisé contrôlé par placebo. Immunology. 2022 ;167 :340-353. doi : 10.1111/imm.13540. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 82. Tabarsi P., Anjidani N., Shahpari R., Mardani M., Sabzvari A., Yazdani B., Kafi H., Fallah N., Ebrahimi A., Taheri A. et al. Évaluation de l’efficacité et de l’innocuité de SpikoGen®, un vaccin à protéine de pointe du coronavirus 2 du syndrome respiratoire aigu sévère avec adjuvant Advax-CpG55.2 : un essai randomisé de phase 3 contrôlé par placebo. Clin. Microbiol. Infecter. Rév.2023 ;29 : 215-2 est ce que je : 10.1016/j.cmi.2022.09.001. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar
- 83. Scendoni R., Cingolani M. Que savons-nous du mécanisme pathologique et du profil des lésions pulmonaires liées au variant Omicron du SARS-CoV-2 ? Diagn. Pathol. 2023 ;18 :18. doi : 10.1186/s13000-023-01306-y. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 84. Ministère de la Santé et des Soins aux personnes âgées. Comirnaty (Pfizer). Gouvernement australien [(consulté le 11 juin 2023)] ; 2022 Disponible en ligne : https://www.health.gov.au/our-work/covid-19-vaccines/our-vaccines/pfizer .
- 85. Administration des produits thérapeutiques (TGA) Vaccin bivalent Moderna COVID-19 (SPIKEVAX Bivalent Original/Omicron BA.4-5) Dose de rappel. Ministère australien de la Santé et des Soins aux personnes âgées. [(consulté le 11 juin 2023)] ; 2023 Disponible en ligne : https://www.tga.gov.au/products/covid-19/covid-19-vaccines/covid-19-vaccine-provisional-registrations/moderna-covid-19-bivalent-spikevax-bivalent-originalomicron-ba4-5-booster-dose-vaccine .
- 86. Cosentino M., Marino F. Comprendre la pharmacologie des vaccins à ARNm contre la COVID-19 : un pari risqué ? Int. J. Mol. Sci. 2022 ;23 :10881. doi : 10.3390/ijms231810881. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 87. Singh HN, Singh AB. La sous-unité S2 du SARS-CoV-2 interagit avec la protéine suppresseur de tumeur p53 et BRCA : une étude in silico. Transl. Oncol. 2020 ;13 :100814. doi : 10.1016/j.tranon.2020.100814. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 88. Barreda D., Santiago C., Rodríguez JR, Rodríguez JF, Casasnovas JM, Mérida I., Ávila-Flores A. La protéine Spike du SRAS-CoV-2 et son domaine de liaison au récepteur favorisent un profil d’activation proinflammatoire sur les cellules dendritiques humaines. Cellules. 2021;10:3279. est ce que je: 10.3390/cells10123279. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 89. Suzuki YJ, Nikolaienko SI, Dibrova VA, Dibrova YV, Vasylyk VM, Novikov MY, Shults NV, Gychka SG SARS-CoV-2, signalisation cellulaire médiée par la protéine de pointe dans les cellules vasculaires pulmonaires. Vasculaire. Pharmacol. 2021;137:106823. est ce que je: 10.1016/j.vph.2020.106823. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 90. Colunga Biancatelli RML, Solopov PA, Sharlow ER, Lazo JS, Marik PE, Catravas JD. La sous-unité S1 de la protéine Spike du SARS-CoV-2 induit une lésion pulmonaire aiguë de type COVID-19 chez les souris transgéniques K18-hACE2 et un dysfonctionnement de la barrière endothéliale dans les cellules endothéliales humaines. Am. J. Physiol. Lung Cell. Mol. Physiol. 2021;321:L477–L484. doi: 10.1152/ajplung.00223.2021. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 91. McKernan K., Kyriakopoulos AM, McCullough PA. Différences dans l’ARNm dérivé du vaccin et de la réplication du SARS-CoV-2 : implications pour la biologie cellulaire et les futures maladies. OSF Preprints. 2021. doi : 10.31219/osf.io/bcsa6. [ DOI ] [ Google Scholar ]
- 92. Lei Y., Zhang J., Schiavon CR, He M., Chen L., Shen H., Zhang Y., Yin Q., Cho Y., Andrade L., et al. La protéine Spike du SRAS-CoV-2 altère la fonction endothéliale via une régulation négative de l’ACE 2. Circ. Rés. 2021 ; 128 : 1323-1326. est ce que je: 10.1161/CIRCRESAHA.121.318902. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- [ Article gratuit PMC ] [ PubMed ] 93. Nadwa EH, Al-Kuraishy HM, Al-Gareeb AI, Elekhnawy E, Albogami SM, Alorabi M, Batiha GE, De Waard M. Dysfonctionnement cholinergique dans le COVID-19 : recherche frénétique et espoir du meilleur. Nommé Arche de Schmiedebergs. Pharmacol. Rév. 2023 ; 396 : 453-468. est ce que je: 10.1007/s00210-022-02346-9. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar
- [ PubMed ] 94. Alexandris N, Lagoumintzis G, Chasapis CT, Leonidas DD, Papadopoulos GE, Tzartos SJ, Tsatsakis A, Eliopoulos E, Poulas K, Farsalinos K. Système cholinergique nicotinique et COVID-19 : Toxicol. Rep. Rev. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar
- 95. Hollenhorst MI, Krasteva-Christ G. Récepteurs nicotiniques de l’acétylcholine dans les voies respiratoires. Molecules. 2021;26:6097. doi : 10.3390/molecules26206097. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 96. Al-Kuraishy HM, Al-Gareeb AI, Qusti S., Alshammari EM, Gyebi GA, Batiha GE Dysautonomie induite par Covid-19 : une menace de tempête sympathique. ASN Neuro. 2021;13:17590914211057635. est ce que je: 10.1177/17590914211057635. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar
- 97. Patterson BK, Seethamraju H., Dhody K., Corley MJ, Kazempour K., Lalezari J., Pang APS, Sugai C., Mahyari E., Francisco EB, et al. L’inhibition de CCR5 chez les patients atteints de COVID-19 grave diminue les cytokines inflammatoires, augmente le nombre de lymphocytes T CD8 et réduit la charge virale du SARS-CoV-2 dans le plasma au 14e jour. Int. J. Infect. Dis. 2021;103:25–32. doi: 10.1016/j.ijid.2020.10.101. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 98. Henrion-Caude A. Spikopathie : la pathologie de la protéine Spike. Communication présentée à l’Assemblée générale du Conseil mondial de la santé. worldcouncilforhealth.org. 2021. [Consulté le 7 avril 2023]. Disponible en ligne : https://worldcouncilforhealth.org/multimedia/alexandra-henrion-caude-france-spikopathy/
- 99. Anderson S. Le CBER prévoit de surveiller l’innocuité et l’efficacité du vaccin contre la COVID-19. Agence américaine des produits alimentaires et médicamenteux (FDA) : Réunion du Comité consultatif sur les vaccins et les produits biologiques connexes. [(consulté le 7 avril 2023)] ; 2020. Disponible en ligne : https://www.fda.gov/media/143557/download .
- 100. React19. Plus de 3 400 publications et rapports de cas sur les vaccins contre la COVID-19. 2022. [Consulté le 11 juin 2023]. Disponible en ligne : https://react19.org/1250-covid-vaccine-reports/
- 101. Avolio E., Carrabba M., Milligan R., Kavanagh Williamson M., Beltrami AP, Gupta K., Elvers KT, Gamez M., Foster RR, Gillespie K., et al. La protéine Spike du SARS-CoV-2 perturbe la fonction des péricytes cardiaques humains par la voie de signalisation médiée par le récepteur CD147 : un mécanisme non infectieux potentiel de la microangiopathie associée à la COVID-19. Clin. Sci. 2021 ;135 :2667-2689. doi : 10.1042/CS20210735. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 102. Cao X., Nguyen V., Tsai J., Gao C., Tian Y., Zhang Y., Carver W., Kiaris H., Cui T., Tan W. La protéine Spike du SARS-CoV-2 induit des perturbations transcriptionnelles à long terme des gènes du métabolisme mitochondrial, provoque une fibrose cardiaque et réduit la contractilité myocardique chez les souris obèses. Mol. Metab. 2023;74:101756. doi : 10.1016/j.molmet.2023.101756. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 103. Baumeier C., Aleshcheva G., Harms D., Gross U., Hamm C., Assmus B., Westenfeld R., Kelm M., Rammos S., Wenzel P., et al. Inflammation intramyocardique après vaccination contre la COVID-19 : une série de cas confirmée par biopsie endomyocardique. Int. J. Mol. Sci. 2022 ;23 :6940. doi : 10.3390/ijms23136940. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- [ Article gratuit PMC ] [ PubMed ] 104. Barmada A, Klein J, Ramaswamy A, Brodsky NN, Jaycox JR, Sheikha H, Jones KM, Habet V, Campbell M, Sumida TS et al. Cytokinopathie avec lymphocytes cytotoxiques aberrants et réponse myéloïde profibrotique dans la myocardite associée au vaccin à ARNm du SRAS-CoV-2. Sci. Immunol. 2023;8 : eadh3455. est ce que je: 10.1126/sciimmunol.adh3455. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar
- 105. Wu CT, Chin SC, Chu PH. Myocardite fulminante aiguë après vaccination ChAdOx1 nCoV-19 : présentation de cas et revue de la littérature. Front. Cardiovasc. Med. 2022 ;9 :856991. doi : 10.3389/fcvm.2022.856991. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 106. Sulemankhil I., Abdelrahman M., Negi SI. Association temporelle entre le vaccin COVID-19 Ad26.COV2.S et la myocardite aiguë : étude de cas et revue de la littérature. Cardiovasc. Revasc. Med. 2022 ;38 :117-123. doi : 10.1016/j.carrev.2021.08.012. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 107. Olejniczak M., Schwartz M., Webber E., Shaffer A., Perry TE. Myocardite virale : incidence, diagnostic et prise en charge. J. Cardiothorac. Vasc. Anesth. 2020 ;34 :1591-1601. doi : 10.1053/j.jvca.2019.12.052. [ DOI ] [ PubMed ] [ Google Scholar ]
- 108. Basso C. Myocardite. N. Engl. J. Med. 2022;387:1488–1500. doi : 10.1056/NEJMra2114478. [ DOI ] [ PubMed ] [ Google Scholar ]
- 109. Simone A., Herald J., Chen A., Gulati N., Shen AY, Lewin B., Lee MS. Myocardite aiguë après vaccination contre la COVID-19 par ARNm chez les adultes de 18 ans et plus. JAMA Intern. Med. 2021;181:1668–1670. doi : 10.1001/jamainternmed.2021.5511. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 110. Lane S., Yeomans A., Shakir S. Revue systématique des déclarations spontanées de myocardite et de péricardite chez les patients transplantés et les patients immunodéprimés après vaccination contre la COVID-19 par ARNm. BMJ Open. 2022;12:e060425. doi : 10.1136/bmjopen-2021-060425. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 111. Naik R. FDA : Résumé des fondements de l’action réglementaire. fda.gov. [(consulté le 8 novembre 2022)] ; 2021 Disponible en ligne : https://www.fda.gov/media/151733/download .
- 112. Tschöpe C., Ammirati E., Bozkurt B., Caforio ALP, Cooper LT, Felix SB, Hare JM, Heidecker B., Heymans S., Hübner N., et al. Myocardite et cardiomyopathie inflammatoire : données actuelles et perspectives. Nat. Rev. Cardiol. 2021 ;18 :169-193. doi : 10.1038/s41569-020-00435-x. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- [Article PMC gratuit] [PubMed] 113. Mansanguan S., Charunwatthana P., Piyaphanee W., Dechkhajorn W., Poolcharoen A., Mansanguan C. Manifestations cardiovasculaires du vaccin anti-COVID-19 à ARNm BNT162b2 chez les adolescents. Trop nombreux. Med. Infect. This. 2022;7:1 doi: 10.3390/tropicalmed7080196. [ DOI ] [ Article PMC gratuit ] [ PubMed ] [ Google Scholar]
- 114. Müller C., Buergin N., Lopez-Ayala P., Hirsiger JR, Mueller P., Median D., Glarner N., Rumora K., Herrmann T., Koechlin L., et al. Différences liées au sexe dans l’incidence des lésions myocardiques après une vaccination de rappel contre la COVID-19 par le vaccin ARNm-1273. Eur. J. Heart Fail. 2023. Manuscrit d’auteur accepté . [ DOI ] [ PubMed ]
- 115. Manno EC, Amodio D., Cotugno N., Rossetti C., Giancotta C., Santilli V., Zangari P., Rotulo GA, Villani A., Giglioni E., et al. Des taux élevés de troponine à l’admission sont associés à des lésions persistantes à l’IRM cardiaque chez les enfants développant une myocardite après vaccination contre la COVID-19 par un vaccin à ARNm. Pediatr. Infect. Dis. J. 2023;42:166–171. doi: 10.1097/INF.0000000000003762. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 116. Dowd E. Cause inconnue : l’épidémie de morts subites en 2021 et 2022. Children’s Health Defence ; Washington, DC, États-Unis : 2022. [ Google Scholar ]
- 117. Dowd E., Nunes Y., Alegria C. Données américaines sur l’invalidité : Partie 4 — Relation avec la surmortalité. Bureau of Labor Statistics (BLS). Phinancetechnologies.com. 2022. [(consulté le 8 novembre 2022)]. Disponible en ligne : https://phinancetechnologies.com/HumanityProjects/US%20Disabilities%20-%20Part4.htm .
- 118. Therapeutic Goods Administration (TGA), Réponse à la demande d’accès à l’information 4093-02, Comité consultatif sur les vaccins (ACV), réunion 22, procès-verbal sur le point 2.1, vaccin BNT162b2 [ARNm]. [(consulté le 7 avril 2023)] ; 2021 Disponible en ligne : https://www.tga.gov.au/sites/default/files/2023-03/foi-4093-02.pdf .
- 119. Angeli F., Spanevello A., Reboldi G., Visca D., Verdecchia P. Vaccins contre le SARS-CoV-2 : points forts et points faibles. Eur. J. Intern. Med. 2021 ;88 :1–8. doi : 10.1016/j.ejim.2021.04.019. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 120. Angeli F., Reboldi G., Trapasso M., Zappa M., Spanevello A., Verdecchia P. COVID-19, vaccins et déficit en ACE2 et autres angiotensinases. Boucler la boucle sur l’« effet pic ». Eur. J. Intern. Med. 2022 ;103 :23-28. doi : 10.1016/j.ejim.2022.06.015. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- [ PubMed ] 121. Kuhn CC, Basnet N, Bodakuntla S, Alvarez-Brecht P, Nichols S, Martinez-Sanchez A, Agostini L, Soh YM, Takagi J, Biertümpfel C et al. Observation directe Cryo-ET de la déformation plaquettaire induite par la protéine de pointe du SRAS-CoV-2. Nat. Commun. 2023;14:6 est ce que je : 10.1038/s41467-023-36279-5. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar
- 122. Zheng Y., Zhao J., Li J., Guo Z., Sheng J., Ye X., Jin G., Wang C., Chai W., Yan J., et al. La protéine Spike du SARS-CoV-2 provoque la coagulation sanguine et la thrombose par liaison compétitive à l’héparane sulfate. Int. J. Biol. Macromol. 2021;193:1124–1129. doi: 10.1016/j.ijbiomac.2021.10.112. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 123. Ryu JK, Sozmen EG, Dixit K., Montano M., Matsui Y., Liu Y., Helmy E., Deerinck TJ, Yan Z., Schuck R., et al. La protéine Spike du SARS-CoV-2 induit des caillots sanguins inflammatoires anormaux neutralisés par l’immunothérapie à la fibrine. bioRxiv. 2021 doi: 10.1101/2021.10.12.464152. prépublication . [ DOI ] [ Google Scholar ]
- 124. Boschi C., Scheim DE, Bancod A., Militello M., Bideau ML, Colson P., Fantini J., Scola B. La protéine Spike du SARS-CoV-2 induit une hémagglutination : implications pour la morbidité et les traitements de la COVID-19 et pour les effets indésirables des vaccins. Int. J. Mol. Sci. 2022 ;23 :15480. doi : 10.3390/ijms232415480. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 125. Purnell MC, Skrinjar TJ. Amélioration du champ bioélectrique : influence sur le potentiel membranaire et la migration cellulaire in vitro. Adv. Wound Care. 2016 ;5 :539-545. doi : 10.1089/wound.2016.0708. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 126. Purnell MC, Skrinjar TJ. Dissociation diélectrophorétique des ions chlorure et son influence sur l’anisotropie diamagnétique des membranes cellulaires. Discov. Med. 2016;22:257–273. [ PubMed ] [ Google Scholar ]
- 127. Papasimakis N., Fedotov VA, Savinov V., Raybould TA, Zheludev NI Excitations toroïdales électromagnétiques dans la matière et l’espace libre. Nat. Maître. 2016 ; 15 : 263-271. est ce que je: 10.1038/nmat4563. [ DOI ] [ PubMed ] [ Google Scholar ]
- 128. Purnell MC, Butawan MBA, Ramsey RD. Réseau de champs biologiques : une excitation électromagnétique toroïdale diélectrophorétique pour restaurer et maintenir le nombre d’or dans les érythrocytes humains. Physiol. Rep. 2018 ;6 :e13722. doi : 10.14814/phy2.13722. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 129. Kooijman S., Meurs I., van der Stoep M., Habets KL, Lammers B., Berbée JF, Havekes LM, van Eck M., Romijn JA, Korporaal SJ, et al. Le déficit hématopoïétique en récepteur nicotinique α7 de l’acétylcholine augmente l’inflammation et l’état d’activation plaquettaire, mais n’aggrave pas l’athérosclérose. J. Thromb. Hémost. 2015 ; 13 : 126-135. est ce que je : 10.1111/jth.12765. [ DOI ] [ PubMed ] [ Google Scholar ]
- 130. Li JX, Wang YH, Bair H., Hsu SB, Chen C., Wei JC, Lin CJ. Évaluation du risque d’occlusion vasculaire rétinienne après vaccination contre la COVID-19. NPJ Vaccines. 2023;8:64. doi : 10.1038/s41541-023-00661-7. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 131. Herrera-Comoglio R., Lane S. Thrombocytopénie immunitaire et thrombose induites par le vaccin Spoutnik V. N. Engl. J. Med. 2022;387:1431–1432. doi : 10.1056/NEJMc2210813. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 132. Buoninfante A., Andeweg A., Baker AT, Borad M., Crawford N., Dogné JM, Garcia-Azorin D., Greinacher A., Helfand R., Hviid A., et al. Comprendre le syndrome de thrombocytopénie après vaccination contre la COVID-19. NPJ Vaccines. 2022;7:141. doi : 10.1038/s41541-022-00569-8. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 133. Leung HHL, Perdomo J., Ahmadi Z., Zhen SS, Rashi FN, Enjeti A., Ting SB, Chong JJH, Chong BH. NETose et thrombose dans la thrombocytopénie thrombotique immunologique induite par la vaccination. Nat. Commun. 2022;13:5206. doi: 10.1038/s41467-022-32946-1. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 134. Greinacher A., Schönborn L., Siegerist F., Steil L., Palankar R., Handtke S., Reder A., Thiele T., Aurich K., Methling K., et al. Pathogenèse de la thrombocytopénie thrombotique immunologique induite par la vaccination (TIIV). Seminars Hematol. 2022;59:97–107. doi : 10.1053/j.seminhematol.2022.02.004. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 135. Talotta R., Robertson ES. Anticorps antiphospholipides et risque de thrombophilie post-vaccinale contre la COVID-19 : la goutte d’eau qui fait déborder le vase ? Cytokine Growth Factor Rev. 2021 ;60 :52-60. doi : 10.1016/j.cytogfr.2021.05.001. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 136. Khavinson V., Terekhov A., Kormilets D., Maryanovich A. Homologie entre les protéines du SARS-CoV-2 et les protéines humaines. Sci. Rep. 2021;11:17199. doi : 10.1038/s41598-021-96233-7. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 137. Kelleni M. Vaccination contre le SARS-CoV-2, auto-immunité, facilitation de l’infection par la Covid-19 dépendante des anticorps et autres risques potentiels : la partie émergée de l’iceberg. Int. J. Pulm. Respir. Sci. 2021 ;5 :555658. doi : 10.19080/IJOPRS.2021.05.555658. [ DOI ] [ Google Scholar ]
- 138. S. Alqatari, M. Ismail, M. Hasan, R. Boukhara, R. Al Argan, A. Alwaheed, D. Alkhafaji, S. Ahmed, K. Hadhiah, T. Alamri et al. Émergence de maladies auto-immunes post-vaccinales contre le COVID-19 : une étude monocentrique. Infecter. Résistance aux médicaments. Rév. 2023 ; 16 : 1263-1278. est ce que je: 10.2147/IDR.S394602. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar
- 139. Rodriguez Y., Rojas M., Beltran S., Polo F., Camacho-Dominguez L., Morales SD, Gershwin ME, Anaya JM. Affections auto-immunes et auto-inflammatoires après vaccination contre la COVID-19 : nouveaux cas cliniques et revue de la littérature. J. Autoimmun. 2022 ;132 :102898. doi : 10.1016/j.jaut.2022.102898. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 140. Lansang RP, Amdemichael E., Sajic D. Pemphigus à IgA après vaccination contre la COVID-19 : présentation de cas. SAGE Open Med. Case Rep. 2023 ;11 :2050313X231181022. doi : 10.1177/2050313X231181022. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- [ PubMed ] 141. Minakawa S., Matsuzaki Y., Yao S., Sagara C., Akasaka E., Koga H., Ishii N., Hashimoto T., Sawamura D. Rapport de cas : Un cas d’épidermolyse bulleuse acquise avec des anticorps IgG et IgM anti-membrane basale a rechuté après la vaccination par ARNm contre le COVID-19. Devant. Méd. 2023;10:1093827. est ce que je: 10.3389/fmed.2023.1093827. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar
- [ Article gratuit PMC ] [ PubMed ] 142. Makiyama A., Abe Y., Furusawa H., Kogami M., Ando T., Tada K., Onimaru M., Ishizu A., Yamaji K., Tamura N. Polyartérite noueuse diagnostiquée chez un jeune homme après le vaccin contre le COVID-19 : un rapport de cas. Mod. Rhumatol. Cas Rep. 2023 doi : 10.1093/mrcr/rxad037. [ DOI ] [ PubMed ] [ Google Scholar ]
- 143. Takedani K., Notsu M., Ishiai N., Asami Y., Uchida K., Kanasaki K. Maladie de Graves après exposition au vaccin contre le SARS-CoV-2 : présentation de cas et revue de la littérature. BMC Endocr. Disord. 2023 ;23 :132. doi : 10.1186/s12902-023-01387-2. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 144. Morimoto N., Mori T., Shioji S., Taguchi T., Watanabe H., Sakai K., Mori K., Yamamura A., Hanioka A., Akagi Y., et al. Néphropathie à IgA rapidement progressive avec lésions de type glomérulonéphrite membranoproliférative chez un homme âgé après la troisième dose d’un vaccin anti-COVID-19 à ARNm : présentation de cas. BMC Nephrol. 2023 ;24 :108. doi : 10.1186/s12882-023-03169-3. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 145. Aochi S., Uehara M., Yamamoto M. Maladie liée aux IgG4 apparue après la vaccination contre la COVID-19 par ARNm. Intern. Med. 2023;62:1547–1551. doi : 10.2169/internalmedicine.1125-22. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 146. Cam F., Gok G., Celiker H. Uvéite antérieure granulomateuse après vaccination contre la COVID-19 par un vaccin à ARNm : présentation de cas. Indian J. Ophthalmol. 2023 ;71 :1033-1035. doi : 10.4103/ijo.IJO_1771_22. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- [ PubMed ] 147. Yamamoto M., Keino D., Sumii S., Yokosuka T., Goto H., Inui A., Sogo T., Kawakami M., Tanaka M., Yanagimachi M. Anémie aplasique sévère associée à l’hépatite après la vaccination par ARNm contre le COVID-19. Interne. Méd. 2023 ;62 : 1813-1816. est ce que je : 10.2169/internalmedicine.1308-22. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar
- 148. Talotta R. Les vaccins à ARN contre la COVID-19 présentent-ils un risque de maladies à médiation immunitaire ? En réponse à « Réactivité croisée antigénique potentielle entre le SARS-CoV-2 et les tissus humains, avec un lien possible avec une augmentation des maladies auto-immunes ». Clin. Immunol. 2021 ;224 :108665. doi : 10.1016/j.clim.2021.108665. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 149. Irrgang P., Gerling J., Kocher K., Lapuente D., Steininger P., Habenicht K., Wytopil M., Beileke S., Schäfer S., Zhong J., et al. Changement de classe vers des anticorps IgG4 non inflammatoires et spécifiques de la protéine Spike après vaccination répétée par ARNm du SARS-CoV-2. Sci. Immunol. 2023;8:eade2798. doi: 10.1126/sciimmunol.ade2798. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 150. Uversky VN, Redwan EM, Makis W., Rubio-Casillas A. Les anticorps IgG4 induits par une vaccination répétée pourraient générer une tolérance immunitaire à la protéine Spike du SARS-CoV-2. Vaccines. 2023;11:991. doi : 10.3390/vaccines11050991. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 151. Patel NR, Anzalone ML, Buja LM, Elghetany MT. Mort subite d’origine cardiaque due à une atteinte des artères coronaires par une maladie liée aux IgG4 : une complication rare et grave d’une maladie rare. Arch. Pathol. Lab. Med. 2014 ;138 :833-836. doi : 10.5858/arpa.2012-0614-CR. [ DOI ] [ PubMed ] [ Google Scholar ]
- 152. Gutierrez PS, Schultz T., Siqueira SA, de Figueiredo Borges L. Mort coronarienne subite due à une maladie liée aux IgG4. Cardiovasculaire. Pathol. 2013 ; 22 : 505-507. est ce que je: 10.1016/j.carpath.2013.05.003. [ DOI ] [ PubMed ] [ Google Scholar ]
- 153. Martín-Nares E., Saavedra-González V., Fagundo-Sierra R., Santinelli-Núñez BE, Romero-Maceda T., Calderón-Vasquez K., Hernandez-Molina G. Chaînes légères libres d’immunoglobulines sériques et leur association avec les phénomènes cliniques, la sérologie et l’activité chez les patients atteints d’une maladie liée aux IgG4. Sci. Rep.2021;11:1832. est ce que je: 10.1038/s41598-021-81321-5. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 154. Tsai HC, Tung HY, Liu CW, Su CF, Sun YS, Chen WS, Chen MH, Lai CC, Liao HT, Yang YY, et al. Signification d’un taux élevé d’IgG4 sérique dans les formes complètes ou incomplètes de la maladie liée aux IgG4 : étude rétrospective de 845 patients et sa pertinence clinique. Clin. Rheumatol. 2022 ;41 :115-122. doi : 10.1007/s10067-021-05772-x. [ DOI ] [ PubMed ] [ Google Scholar ]
- 155. Campochiaro C, Ramirez GA, Bozzolo EP, Lanzillotta M, Berti A, Baldissera E, Dagna L, Praderio L, Scotti R, Tresoldi M et al. Maladie liée aux IgG4 en Italie : caractéristiques cliniques et résultats d’une large cohorte de patients. Scand. J. Rhumatol. 2016 ; 45 : 135-145. est ce que je: 10.3109/03009742.2015.1055796. [ DOI ] [ PubMed ] [ Google Scholar
- 156. Wallace ZS, Zhang Y., Perugino CA, Naden R., Choi HK, Stone JH, Comité des critères de classification ACR/EULAR de la maladie liée aux IgG4. Phénotypes cliniques de la maladie liée aux IgG4 : analyse de deux cohortes transversales internationales. Ann. Rheum. Dis. 2019 ;78 :406-412. doi : 10.1136/annrheumdis-2018-214603. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 157. Chen LYC, Mattman A., Seidman MA, Carruthers MN. Maladie liée aux IgG4 : ce qu’un hématologue doit savoir. Haematologica. 2019 ;104 :444-455. doi : 10.3324/haematol.2018.205526. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 158. Lin W., Lu S., Chen H., Wu Q., Fei Y., Li M., Zhang X., Tian X., Zheng W., Leng X., et al. Caractéristiques cliniques de la maladie liée aux immunoglobulines G4 : étude prospective de 118 patients chinois. Rheumatology. 2015 ;54 :1982-1990. doi : 10.1093/rheumatology/kev203. [ DOI ] [ PubMed ] [ Google Scholar ]
- 159. Della-Torre E., Lanzillotta M., Doglioni C. Immunologie des maladies liées aux IgG4. Clin. Exp. Immunol. 2015;181:191–206. doi : 10.1111/cei.12641. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 160. Stone JR. Aortite, péri-aortite et fibrose rétropéritonéale : manifestations d’une maladie systémique liée aux IgG4. Curr. Opin. Rheumatol. 2011 ; 23 : 88-94. doi : 10.1097/BOR.0b013e3283412f7c. [ DOI ] [ PubMed ] [ Google Scholar ]
- 161. Prapruttam D., Hedgire SS, Mani SE, Chandramohan A., Shyamkumar NK, Harisinghani M. Tuberculosis – le grand imitateur. Semin. Echographie CT IRM. 2014 ; 35 : 195-214. est ce que je: 10.1053/j.sult.2014.02.002. [ DOI ] [ PubMed ] [ Google Scholar ]
- 162. (PHMPT) Public Health & Medical Professionals for Transparency, Documents de Pfizer. 2022. [(consulté le 10 juillet 2023)]. Disponible en ligne : https://phmpt.org/
- 163. Pfizer. 5.3.6 Analyse cumulative des déclarations d’effets indésirables post-autorisation du PF-07302048 (BNT162B2) reçues jusqu’au 28 février 2021. FDA-CBER-2021-5683-0000054. Public Health and Medical Professionals for Transparency (PHMPT) [consulté le 14 juillet 2023]. Disponible en ligne : https://phmpt.org/pfizer-16-plus-documents/
- 164. Nuovo GJ, Suster D., Sawant D., Mishra A., Michaille JJ, Tili E. Amplification des lésions du SNC dans la maladie d’Alzheimer due à l’infection par le SARS-CoV-2. Ann. Diagn. Pathol. 2022;61:152057. doi: 10.1016/j.anndiagpath.2022.152057. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 165. Rastogi A., Bingeliene A., Strafella AP, Tang-Wai DF, Wu PE, Mandell DM. Modifications neurologiques et cérébrales réversibles à l’IRM après vaccination contre la COVID-19 : présentation de cas. J. Neuroradiol. 2022 ;49 :428-430. doi : 10.1016/j.neurad.2022.03.011. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 166. Rhea EM, Logsdon AF, Hansen KM, Williams LM, Reed MJ, Baumann KK, Holden SJ, Raber J., Banks WA, Erickson MA. La protéine S1 du SARS-CoV-2 traverse la barrière hémato-encéphalique chez la souris. Nat. Neurosci. 2021;24:368–378. doi : 10.1038/s41593-020-00771-8. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 167. Mörz M. Rapport de cas : Encéphalite nécrosante multifocale et myocardite après vaccination par le vaccin BNT162b2 contre la COVID-19. Vaccines. 2022 ;10 :1651. doi : 10.3390/vaccines10101651. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 168. Kim ES, Jeon MT, Kim KS, Lee S., Kim S., Kim DG. Les protéines Spike du SARS-CoV-2 induisent des modifications pathologiques de la délivrance moléculaire et de la fonction métabolique dans les cellules endothéliales cérébrales. Viruses. 2021;13:2021. doi: 10.3390/v13102021. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- [ Article gratuit PMC ] [ PubMed ] [ Cross Ref ] 169. Khaddaj-Mallat R., Aldib N., Bernard M., Paquette AS, Ferreira A., Lecordier S., Saghatelyan A., Flamand L., ElAli A. Le SARS-CoV-2 dérégule les fonctions vasculaires et immunitaires des péricytes cérébraux via la protéine Spike. Neurobiol. Ce. 2021;161:105561. est ce que je: 10.1016/j.nbd.2021.105561. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar
- 170. Fontes-Dantas FL, Fernandes GG, Gutman EG, De Lima EV, Antonio LS, Hammerle MB, Mota-Araujo HP, Colodeti LC, Araújo SMB, Froz GM, et al. La protéine Spike du SARS-CoV-2 induit un dysfonctionnement cognitif à long terme, médié par TLR4, reproduisant le syndrome post-COVID-19 chez la souris. Cell Rep. 2023;42:112189. doi: 10.1016/j.celrep.2023.112189. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 171. Oh J., Cho WH, Barcelon E., Kim KH, Hong J., Lee SJ. La protéine Spike du SARS-CoV-2 induit un déficit cognitif et un comportement de type anxieux chez la souris par mort neuronale hippocampique non autonome. Sci. Rep. 2022;12:5496. doi: 10.1038/s41598-022-09410-7. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 172. Tillman TS, Chen Q., Bondarenko V., Coleman JA, Xu Y., Tang P. La protéine Spike du SARS-CoV-2 diminue l’expression du récepteur α7nAChR à la surface cellulaire via un motif hélicoïdal dans le col de la protéine Spike. ACS Chem. Neurosci. 2023;14:689–698. doi : 10.1021/acschemneuro.2c00610. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 173. Rong Z., Mai H., Kapoor S., Puelles VG, Czogalla J., Schädler J., Vering J., Delbridge C., Steinke H., Frenzel H., et al. Accumulation de la protéine Spike du SARS-CoV-2 dans l’axe crâne-méninges-cerveau : implications potentielles pour les complications neurologiques à long terme après une infection par la COVID-19. bioRxiv. 2023 : prépublication. doi : 10.1101/2023.04.04.535604. [ DOI ] [ Google Scholar ]
- 174. Olajide OA, Iwuanyanwu VU, Adegbola OD, Al-Hindawi AA. La glycoprotéine S1 de la protéine Spike du SARS-CoV-2 induit une neuroinflammation dans les cellules microgliales BV-2. Mol. Neurobiol. 2022;59:445–458. doi: 10.1007/s12035-021-02593-6. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 175. Wu Z., Zhang X., Huang Z., Ma K. Les protéines du SARS-CoV-2 interagissent avec l’alpha-synucléine et induisent une pathologie de type corps de Lewy in vitro. Int. J. Mol. Sci. 2022;23:3394. doi : 10.3390/ijms23063394. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 176. Winkler ES, Bailey AL, Kafai NM, Sharmila N., McCune BT, Jinsheng Y., Fox JM, Chen RE, Earnest JJ, Keeler SP, et al. L’infection par le SARS-CoV-2 de souris transgéniques pour l’ACE2 humain provoque une inflammation pulmonaire sévère et une altération de la fonction pulmonaire. Nat. Immunol. 2020;21:1327–1335. doi : 10.1038/s41590-020-0778-2. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 177. Lykhmus O., Kalashnyk O., Skok M. La modulation allostérique positive des récepteurs nicotiniques de l’acétylcholine α7 améliore transitoirement la mémoire mais aggrave l’inflammation chez les souris traitées par LPS. Front. Aging Neurosci. 2020;11:359. doi : 10.3389/fnagi.2019.00359. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 178. Lykhmus O., Kalashnyk O., Koval L., Krynina O., Komisarenko S., Skok M. L’immunisation avec le fragment 674–685 de la protéine Spike du SARS-CoV-2 induit une neuroinflammation et altère la mémoire épisodique chez la souris. Biochem. Biophys. Res. Commun. 2022;622:57–63. doi: 10.1016/j.bbrc.2022.07.016. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 179. Villeda SA, Luo J., Mosher KI, Zou B., Britschgi M., Bieri G., Stan TM, Fainberg N., Ding Z., Eggel A., et al. Le milieu systémique vieillissant régule négativement la neurogenèse et les fonctions cognitives. Nature. 2011;477:90–94. doi: 10.1038/nature10357. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 180. Fernández-Castañeda A., Lu P., Geraghty AC, Song E., Lee MH, Wood J., O’Dea MR, Dutton S., Shamardani K., Nwangwu K. et al. Un COVID respiratoire léger peut provoquer une dérégulation des cellules neurales multi-lignées et de la myéline. Cellule. 2022 ; 185 : 2452-2468.e16. est ce que je : 10.1016/j.cell.2022.06.008. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 181. Shrestha NK, Burke PC, Nowacki AS, Simon JF, Hagen A, Gordon SM. Efficacité du vaccin bivalent contre la COVID-19. Open Forum Infect. Dis. 2023;10:ofad209. doi : 10.1093/ofid/ofad209. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 182. Coleman JM, Naik C., Holguin F., Ray A., Ray P., Trudeau JB, Wenzel SE. Expression épithéliale des éotaxines 2 et 3 : relation avec la gravité de l’asthme, l’éosinophilie luminale et l’âge d’apparition. Thorax. 2012 ;67 :1061-1066. doi : 10.1136/thoraxjnl-2012-201634. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 183. Rojas-Ramos E., Avalos AF, Perez-Fernandez L., Cuevas-Schacht F., Valencia-Maqueda E., Teran LM. Rôle des chimiokines RANTES, des protéines chimiotactiques des monocytes-3 et -4, et des éotaxines-1 et -2 dans l’asthme infantile. Eur. Respir. J. 2003;22:310–316. doi: 10.1183/09031936.03.00084802. [ DOI ] [ PubMed ] [ Google Scholar ]
- 184. Holgate ST. Immunologie des muqueuses. Academic Press ; Cambridge, MA, États-Unis : 2015. [ DOI ] [ Google Scholar ]
- 185. Nyström S., Hammarström P. Amyloïdogénèse de la protéine Spike du SARS-CoV-2. J. Am. Chem. Soc. 2022;144:8945–8950. doi : 10.1021/jacs.2c03925. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 186. Maatuk N., Samson AO. Modélisation du mécanisme de liaison du peptide Aβ1-42 de la maladie d’Alzheimer aux récepteurs nicotiniques de l’acétylcholine par similarité avec les α-neurotoxines de serpent. Neurotoxicology. 2013;34:236–242. doi: 10.1016/j.neuro.2012.09.007. [ DOI ] [ PubMed ] [ Google Scholar ]
- 187. Lasala M., Fabiani C., Corradi J., Antollini S., Bouzat C. Modulation moléculaire du récepteur nicotinique α7 humain par les peptides amyloïdes-β. Front. Cell. Neurosci. 2019;13:37. doi : 10.3389/fncel.2019.00037. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 188. Dhakal S., Wyant CE, George HE, Morgan SE, Rangachari V. Le domaine C-terminal de type prion de TDP-43 et l’α-synucléine interagissent de façon synergique pour générer des fibrilles hybrides neurotoxiques. J. Mol. Biol. 2021;433:166953. doi: 10.1016/j.jmb.2021.166953. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 189. Tetz G., Tetz V. Les domaines de type prion de la protéine Spike du SARS-CoV-2 diffèrent selon ses variants et permettent des variations d’affinité pour l’ACE2. Microorganisms. 2022;10:280. doi: 10.3390/microorganisms10020280. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 190. Nonaka T., Hasegawa M. Prions TDP-43. Cold Spring Harb. Perspect. Med. 2018;8:a024463. doi : 10.1101/cshperspect.a024463. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 191. Classen J. Vaccins à ARN contre la COVID-19 et risque de maladie à prions. Microbiol. Infect. Dis. 2021;5:1–3. doi : 10.33425/2639-9458.1109. [ DOI ] [ Google Scholar ]
- 192. Idrees D., Kumar V. Interactions de la protéine Spike du SARS-CoV-2 avec les protéines amyloïdogènes : indices potentiels de la neurodégénérescence. Biochem. Biophys. Res. Commun. 2021 ;554 :94-98. doi : 10.1016/j.bbrc.2021.03.100. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 193. Kuvandik A., Özcan E., Serin S., Sungurtekin H. Maladie de Creutzfeldt-Jakob après vaccination contre la COVID-19. Turk. J. Intensive Care. 2021;20:61–64. doi: 10.4274/tybd.galenos.2021.91885. [ DOI ] [ Google Scholar ]
- 194. Wang F., Wang X., Yuan CG, Ma J. Génération d’un prion à partir d’une protéine prion recombinante exprimée chez la bactérie. Science. 2010;327:1132–1135. doi : 10.1126/science.1183748. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 195. Young MJ, O’Hare M., Matiello M., Schmahmann JD. Maladie de Creutzfeldt-Jakob chez un homme atteint de COVID-19 : neurodégénérescence accélérée par le SARS-CoV-2 ? Brain Behav. Immun. 2020 ;89 :601-603. doi : 10.1016/j.bbi.2020.07.007. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 196. d’Errico P., Meyer-Luehmann M. Mécanismes de propagation des protéines Tau et Aβ pathogènes dans la maladie d’Alzheimer. Front. Aging Neurosci. 2020;12:265. doi : 10.3389/fnagi.2020.00265. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 197. Duda JE, Lee VM, Trojanowski JQ. Neuropathologie des agrégats de synucléine. J. Neurosci. Res. 2000;61:121–127. doi : 10.1002/1097-4547(20000715)61:2&121::AID-JNR1&3.0.CO;2-4. [ DOI ] [ PubMed ] [ Google Scholar ]
- 198. Stefano GB. Aperçu historique des infections et des troubles associés à des séquelles neurologiques et psychiatriques similaires au COVID long. Med. Sci. Monit. 2021;27:e931447. doi : 10.12659/MSM.931447. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 199. MedAlerts.org. Il s’agit de l’identifiant VAERS 1754471. Centre national d’information sur les vaccins : 2021. [(consulté le 4 juillet 2023)]. Disponible en ligne : https://medalerts.org/vaersdb/findfield.php .
- 200. MedAlerts.org. Il s’agit de l’identifiant VAERS 1777781. Centre national d’information sur les vaccins : 2021. [(consulté le 4 juillet 2023)]. Disponible en ligne : https://medalerts.org/vaersdb/findfield.php .
- 201. Bureau australien des statistiques (ABS) Statistiques provisoires sur la mortalité : Période de référence : janv.-déc. 2022 ; abs.gov.au, 2023. [(consulté le 7 juillet 2023)] ; Disponible en ligne : https://www.abs.gov.au/statistics/health/causes-death/provisional-mortality-statistics/jan-dec-2022 .
- 202. Statistiques provisoires de mortalité du Bureau australien des statistiques (ABS). Bureau australien des statistiques (ABS) ; Canberra, Australie : 2023. [ Google Scholar ]
- 203. Kuo PH, Chiang CH, Wang YT, Doudeva LG, Yuan HS. La structure cristalline du complexe TDP-43 RRM1-ADN révèle la reconnaissance spécifique des acides nucléiques riches en UG et TG. Nucleic Acids Res. 2014;42:4712–4722. doi: 10.1093/nar/gkt1407. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 204. King OD, Gitler AD, Shorter J. La partie émergée de l’iceberg : protéines de liaison à l’ARN avec des domaines de type prion dans les maladies neurodégénératives. Brain Res. 2012 ;1462 :61-80. doi : 10.1016/j.brainres.2012.01.016. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 205. Tavassoly O., Safavi F., Tavassoly I. Agrégation des protéines cérébrales induite par le SARS-CoV-2 : une complication possible à long terme de l’infection par la COVID-19. ACS Chem. Neurosci. 2020 ;11 :3704–3706. doi : 10.1021/acschemneuro.0c00676. [ DOI ] [ PubMed ] [ Google Scholar ]
- 206. Mueller BK, Subramaniam S., Senes A. Un motif d’association transmembranaire fréquent, médié par GxxxG, est optimisé pour la formation de liaisons hydrogène interhélicales Calpha-H. Proc. Natl. Acad. Sci. USA. 2014;111:E888–E895. doi: 10.1073/pnas.1319944111. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 207. Prusiner SB. De nouvelles particules infectieuses protéiques sont à l’origine de la tremblante du mouton. Science. 1982;216:136–144. doi : 10.1126/science.6801762. [ DOI ] [ PubMed ] [ Google Scholar ]
- 208. Decock M., Stanga S., Octave JN, Dewachter I., Smith SO, Constantinescu SN, Kienlen-Campard P. Les glycines des motifs transmembranaires GXXXG/GXXXA de l’APP favorisent la formation d’oligomères Aβ pathogènes dans les cellules. Front. Aging Neurosci. 2016;8:107. doi: 10.3389/fnagi.2016.00107. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 209. Seneff S., Nigh G. Pire que la maladie ? Examen de certaines conséquences imprévues possibles des vaccins à ARNm contre la COVID-19. Int. J. Vaccine Theory Pract. Res. 2021 ;2 :38–79. doi : 10.56098/ijvtpr.v2i1.23. [ DOI ] [ Google Scholar ]
- 210. Liu-Yesucevitz L., Bilgutay A., Zhang YJ, Vanderweyde T., Citro A., Mehta T., Zaarur N., McKee A., Bowser R., Sherman M., et al. La protéine de liaison à l’ADN Tar-43 (TDP-43) s’associe aux granules de stress : analyse de cellules en culture et de tissus cérébraux pathologiques. PLoS ONE. 2010 ;5 :e13250. doi : 10.1371/journal.pone.0013250. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 211. Bosco DA, Lemay N., Ko HK, Zhou H., Burke C., Kwiatkowski TJ, Jr., Sapp P., McKenna-Yasek D., Brown RH, Jr., Hayward LJ. Les protéines FUS mutantes responsables de la sclérose latérale amyotrophique s’incorporent aux granules de stress. Hum. Mol. Genet. 2010;19:4160–4175. doi: 10.1093/hmg/ddq335. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 212. Cox PA, Richer R., Metcalf JS, Banack SA, Codd GA, Bradley WG. Exposition aux cyanobactéries et au BMAA provenant de la poussière du désert : un lien possible avec la SLA sporadique chez les vétérans de la guerre du Golfe. Amyotroph. Lateral Scler. 2009 ; 10 (Suppl S2) : 109-117. doi : 10.3109/17482960903286066. [ DOI ] [ PubMed ] [ Google Scholar ]
- 213. Stefano GB, Buttiker P., Weissenberger S., Anders M., Raboch J., Ptacek R., Kream RM. Implication potentielle des prions dans la neuropathologie du COVID long, y compris les troubles du comportement. Cell. Mol. Neurobiol. 2023;43:2621–2626. doi : 10.1007/s10571-023-01342-8. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 214. Donaldson DS, Bradford BM, Else KJ, Mabbott NA. Apparition accélérée d’une maladie à prions du SNC chez des souris co-infectées par un helminthe gastro-intestinal pathogène durant la phase préclinique. Sci. Rep. 2020;10:4554. doi: 10.1038/s41598-020-61483-4. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 215. Liddelow SA, Guttenplan KA, Clarke LE, Bennett FC, Bohlen CJ, Schirmer L., Bennett ML, Munch AE, Chung WS, Peterson TC, et al. Les astrocytes réactifs neurotoxiques sont induits par la microglie activée. Nature. 2017;541:481–487. doi : 10.1038/nature21029. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 216. Makarava N., Chang JC, Molesworth K., Baskakov IV. Dans les maladies à prions, la signature homéostatique gliale spécifique à certaines régions cérébrales est remplacée par une signature de neuroinflammation uniforme, commune à différentes régions du cerveau et à différentes souches de prions présentant un tropisme cellulaire différent. Neurobiol. Dis. 2020;137:104783. doi: 10.1016/j.nbd.2020.104783. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 217. Xu J., Wei H., You P., Sui J., Xiu J., Zhu W., Xu Q. Des anticorps non neutralisants dirigés contre des épitopes linéaires apparentés au SARS-CoV-2 induisent un comportement de type psychotique chez la souris. Front. Mol. Neurosci. 2023;16:1177961. doi : 10.3389/fnmol.2023.1177961. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 218. Kyriakopoulos AM, Nigh G., McCullough PA, Seneff S. L’activation de la protéine kinase activée par les mitogènes (MAPK), l’inhibition de p53 et de l’autophagie caractérisent la neurotoxicité induite par la protéine Spike du coronavirus 2 du syndrome respiratoire aigu sévère (SARS-CoV-2). Cureus. 2022;14:e32361. doi : 10.7759/cureus.32361. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 219. Thomas CA, Paquola ACM, Muotri AR. Rétrotransposition de LINE-1 dans le système nerveux. Annu. Rev. Cell Dev. Biol. 2012;28:555–573. doi : 10.1146/annurev-cellbio-101011-155822. [ DOI ] [ PubMed ] [ Google Scholar ]
- 220. Terry DM, Devine SE. Niveaux anormalement élevés d’expression somatique de LINE-1 et de rétrotransposition dans les troubles neurologiques humains. Front. Genet. 2020;10:1244. doi : 10.3389/fgene.2019.01244. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 221. Shamila D., Alipoor SD, Moratz E., Garssen J., Movassaghi M., Mirsaeidi M., Adcock IM. Exosomes et microARN exosomal dans les maladies respiratoires. Mediat. Inflamm. 2016;2016:5628404. doi : 10.1155/2016/5628404. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 222. Visacri MB, Nicoletti AS, Pincinato EC, Loren P., Saavedra N., Saavedra K., Salazar LA, Moriel P. Rôle des microARN comme biomarqueurs de la COVID-19 : revue exploratoire de l’état actuel et des perspectives de recherche dans ce domaine. Biomark. Med. 2021 ;15 :1785-1795. doi : 10.2217/bmm-2021-0348. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 223. Pogue AI, Lukiw WJ. microARN-146a-5p, infection virale neurotrope et maladie à prions (PrD). Int. J. Mol. Sci. 2021;22:9198. doi : 10.3390/ijms22179198. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 224. Lukiw WJ, Dua P., Pogue AI, Eicken C., Hill JM. Surexpression du microARN-146a (miRNA-146a), un marqueur de la neurodégénérescence inflammatoire, dans la maladie de Creutzfeldt-Jakob sporadique (MCJs) et le syndrome de Gerstmann-Straussler-Scheinker (GSS). J. Toxicol. Environ. Health A. 2011;74:1460–1468. doi: 10.1080/15287394.2011.618973. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 225. Norrby E. Prions et maladies du repliement des protéines. J. Intern. Med. 2011;270:1–14. doi : 10.1111/j.1365-2796.2011.02387.x. [ DOI ] [ PubMed ] [ Google Scholar ]
- 226. Horwich AL, Weissman JS. Conformations mortelles — Mauvais repliement des protéines dans les maladies à prions. Cell. 1997 ;89 :499-510. doi : 10.1016/S0092-8674(00)80232-9. [ DOI ] [ PubMed ] [ Google Scholar ]
- [ PubMed ] 227. Tripathi U, Nchioua R, Prata LGPL, Zhu Y, Gerdes EOW, Giorgadze N, Pirtskhalava T, Parker E, Xue A, Espindola-Netto JM et al. Le SRAS-CoV-2 provoque la sénescence dans les cellules humaines et exacerbe le phénotype sécrétoire associé à la sénescence via TLR-3. Vieillissement. 2021 ; 13 : 21838-21854. est ce que je : 10.18632/aging.203560. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar
- 228. Sfera A., Thomas K., Sfera D., Anton J., Andronescu C., Jafri N., Susanna S., Kozlakidis Z. Les vaccins à ARN messager induisent-ils un syndrome syncytial pathologique ? Int. J. Pathol. Clin. Res. 2022;8:137. [ Google Scholar ]
- 229. Huang L., Jin R., Li J., Luo K., Huang T., Wu D., Wang W., Chen R., Xiao G. L’encombrement macromoléculaire transforme la PrPC recombinante humaine en bêta-oligomères neurotoxiques solubles. FASEB J. 2010;24:3536–3543. doi : 10.1096/fj.09-150987. [ DOI ] [ PubMed ] [ Google Scholar ]
- 230. Dalgleish A. Entretien avec le professeur Angus Dalgleish. Immunothérapie. 2016;8:1271–1276. doi : 10.2217/imt-2016-0120. [ DOI ] [ PubMed ] [ Google Scholar ]
- 231. Dalgleish A. En tant qu’oncologue, je constate une progression rapide de la maladie chez des patients atteints d’un cancer stable après l’administration forcée d’une injection de rappel. Lettre au Dr Abbassi, rédacteur en chef du BMJ. dailysceptic.org. 2022. [Consulté le 11 juin 2023]. Disponible en ligne : https://dailysceptic.org/2022/11/26/as-an-oncologist-i-am-seeing-people-with-stable-cancer-rapidly-progress-after-being-forced-to-have-a-booster/
- 232. Pio R., Ajona D., Ortiz-Espinosa S., Mantovani A., Lambris JD. Complémentarité du cycle cancer-immunité. Front. Immunol. 2019;10:774. doi: 10.3389/fimmu.2019.00774. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 233. Alsaab HO, Sau S., Alzhrani R., Tatiparti K., Bhise K., Kashaw SK, Lyer AK. Inhibition de la signalisation des points de contrôle PD-1 et PD-L1 pour l’immunothérapie du cancer : mécanisme, combinaisons et résultats cliniques. Front. Pharmacol. 2017 ;8 :561. doi : 10.3389/fphar.2017.00561. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 234. Bishawi M., Bowles D., Pla MM, Oakes F., Chiang YS, Schroder J., Milano C., Glass C. Expression de PD-1 et PD-L1 dans la transplantation cardiaque. Cardiovasc. Pathol. 2021;54:107331. doi : 10.1016/j.carpath.2021.107331. [ DOI ] [ PubMed ] [ Google Scholar ]
- 235. Loacker L., Kimpel J., Bánki Z., Schmidt CQ, Griesmacher A., Anliker M. Augmentation de l’expression de PD-L1 à la surface des granulocytes et des monocytes du sang périphérique après vaccination par un vaccin à ARNm ou un vecteur du SARS-CoV-2. Clin. Chem. Lab. Med. 2022;61:e17–e19. doi: 10.1515/cclm-2022-0787. [ DOI ] [ PubMed ] [ Google Scholar ]
- 236. Diskin C., Ryan TAJ, O’Neill LJ. Modification des protéines par les métabolites dans l’immunité. Immunity. 2021;54:19–31. doi : 10.1016/j.immuni.2020.09.014. [ DOI ] [ PubMed ] [ Google Scholar ]
- 237. Mishra R., Banerjea AC. La protéine Spike du SARS-CoV-2 cible l’axe USP33-IRF9 via le miR-148a exosomal pour activer la microglie humaine. Front. Immunol. 2021;12:656700. doi: 10.3389/fimmu.2021.656700. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 238. Seneff S., Nigh G., Kyriakopoulos AM, McCoulough PA. Suppression de l’immunité innée par la vaccination contre le SARS-CoV-2 : rôle des G-quadruplexes, des exosomes et des microARN. Food Chem. Toxicol. 2022 ;164 :113008. doi : 10.1016/j.fct.2022.113008. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 239. Hofer MJ, Li W., Lim SL, Campbell IL. L’interféron alpha de type I induit une maladie neurologique plus sévère en l’absence de la molécule de signalisation canonique, le facteur de régulation de l’interféron 9. J. Neurosci. 2010;30:1149–1157. doi : 10.1523/JNEUROSCI.3711-09.2010. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 240. Rasmussen SA, Abul-Husn NS, Casanova JL, Daly MJ, Rehm HL, Murray MF. L’intersection de la génétique et de la COVID-19 en 2021 : aperçu du symposium Rodney Howell 2021. Genet. Med. 2021 ; 23 : 1001-1003. doi : 10.1038/s41436-021-01113-0. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 241. Liu J., Wang J., Xu J., Xia H., Wang Y., Zhang C., Chen W., Zhang H., Liu Q., Zhu R., et al. Des investigations approfondies ont révélé des altérations physiopathologiques constantes après la vaccination contre la COVID-19. Cell Discov. 2021;7:99. doi: 10.1038/s41421-021-00329-3. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 242. Li S., Silvestri V., Leslie G., Rebbeck TR, Neuhausen SL, Hopper JL, Nielsen HR, Lee A., Yang X., McGuffog L., et al. Risques de cancer associés aux variants pathogènes des gènes BRCA1 et BRCA2. J. Clin. Oncol. 2022;40:1529–1541. doi : 10.1200/JCO.21.02112. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 243. Nuovo GJ, Magro C., Shaffer T., Awad H., Suster D., Mikhail S., He B., Michaille JJ, Liechty B., Tili E. Les lésions des cellules endothéliales constituent l’élément central de la COVID-19 et d’un modèle murin induit par l’injection de la sous-unité S1 de la protéine Spike. Ann. Diagn. Pathol. 2021;51:151682. doi: 10.1016/j.anndiagpath.2020.151682. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- [Article PMC gratuit] [PubMed ] 244. Mezache L, Nuovo GJ, Suster D, Tili E, Awad H, Radwański PB, Veeraraghavan R. Corrélations histologiques, virales et moléculaires des atteintes cardiaques chez les patients décédés de la COVID-19. Ann. Diagn. Pathol. 2022;60:151983. doi : 10.1016/j.informationpath.2022.151983. [ DOI ] [ Article PMC gratuit ] [ PubMed ] [ Google Scholar]
- 245. Choi J. Fauci : La quantité de virus dans les « cas de transmission émergents du delta » est presque identique à celle des personnes non vaccinées. The Hill : Thehill.com. 2021. [Consulté le 7 avril 2023]. Disponible en ligne : https://thehill.com/homenews/sunday-talk-shows/565831-fauci-amount-of-virus-in-breakthrough-delta-cases-almost-identical/
- 246. Schwab C., Domke LM, Hartmann L., Stenzinger A., Longerich T., Schirmacher P. Caractérisation histopathologique post-mortem de la myocardite après vaccination anti-SARS-CoV-2. Clin. Res. Cardiol. 2023;112:431–440. doi : 10.1007/s00392-022-02129-5. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 247. Burkhardt A. Étude d’autopsie/histologie de Reutlingen : Effets secondaires des vaccins contre la COVID-19. Présentation PowerPoint (en allemand). Corona-blog.net. 2022. [Consulté le 7 avril 2023]. Disponible en ligne : https://corona-blog.net/2022/03/10/reutlinger-autopsie-histologie-studie-nebenwirkungen-und-todesfaelle-durch-die-corona-impfungen/
- 248. Burkhardt A. Conférence de pathologie : Production de protéine Spike induite par la vaccination dans le cerveau, les organes, etc., désormais prouvée. Report24.news. 2022. [Consulté le 7 avril 2023]. Disponible en ligne : https://report24.news/pathologie-konferenz-impfinduzierte-spike-produktion-in-gehirn-ua-organen-nun-erwiesen/
- 249. Domazet-Lošo T. Vaccins à ARNm : pourquoi la biologie de la rétroposition est-elle ignorée ? Genes. 2022 ;13 :719. doi : 10.3390/genes13050719. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 250. Dopp K., Seneff S. Les données sur la COVID-19 et la mortalité toutes causes confondues par groupe d’âge révèlent que le risque de décès induit par le vaccin contre la COVID est égal ou supérieur au risque de décès dû à la COVID pour tous les groupes d’âge de moins de 80 ans au 6 février 2022. Vixra.org. 2022;21:preprint. [ Google Scholar ]
- 251. Bajaj V., Gadi N., Spihlman AP, Wu SC, Choi CH, Moulton VR. Vieillissement, immunité et COVID-19 : comment l’âge influence-t-il la réponse immunitaire de l’hôte aux infections à coronavirus ? Front. Physiol. 2020 ;11 :571416. doi : 10.3389/fphys.2020.571416. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 252. Chen Y., Li C., Liu F., Ye Z., Song W., Lee ACY, Shuai H., Lu L., To KK, Chan JF, et al. Infection à SARS-CoV-2 chez un modèle murin, associée à l’âge et modifications de la réponse immunitaire. Emerg. Microbes Infect. 2022;11:368–383. doi: 10.1080/22221751.2022.2026741. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]
- 253. Vo AD, La J., Wu JT, Strymish JM, Ronan M., Brophy M., Do NV, Branch-Elliman W., Fillmore NR, Monach PA. Facteurs associés aux formes graves de COVID-19 chez les adultes vaccinés traités dans les hôpitaux des anciens combattants américains. JAMA Netw. Open. 2022;5:e2240037. doi: 10.1001/jamanetworkopen.2022.40037. [ DOI ] [ Article gratuit PMC ] [ PubMed ] [ Google Scholar ]