Abstrait
Arrière-plan
Dans la phase post-pandémique, l’intérêt d’une vaccination de rappel annuelle contre le SRAS-CoV-2 chez les professionnels de santé reste incertain. Dans cette étude de cohorte multicentrique, nous avons cherché à déterminer l’association entre le statut vaccinal contre le SRAS-CoV-2 et d’autres facteurs de risque, d’une part, et la survenue d’un syndrome respiratoire grippal et d’autre part, les journées de travail perdues en raison de ce syndrome.
Méthodes
Durant une période de forte transmission communautaire du SRAS-CoV-2 (de novembre 2023 à mai 2024), nous avons recueilli des données hebdomadaires sur les symptômes et les congés maladie, et utilisé une régression binomiale négative pour identifier les facteurs de risque de ces résultats chez 1 745 professionnels de santé. Afin de mettre en évidence l’effet du vaccin et de tenir compte des facteurs de confusion potentiels, une analyse de probabilité inverse pondérée a été réalisée.
Résultats
Dans les deux analyses, nous montrons qu’un plus grand nombre de vaccinations contre le SRAS-CoV-2 est associé à un risque accru de maladie respiratoire pseudo-grippale et d’absentéisme. Pour ce qui est de la maladie respiratoire pseudo-grippale, l’association est plus forte avec une vaccination plus récente qu’avec le nombre de vaccinations, ce qui suggère que l’effet s’atténue avec le temps. En revanche, la vaccination contre la grippe saisonnière est associée à une diminution du risque pour ces deux événements.
Conclusions
Sur la base de nos données, nous concluons que la vaccination de rappel contre le SRAS-CoV-2 ne contribue pas à la protection du personnel soignant dans un contexte post-pandémique. La vaccination contre le SRAS-CoV-2 pourrait même augmenter temporairement le risque d’infection symptomatique et d’absentéisme.
Résumé en langage clair
Dans les années qui ont suivi la pandémie de COVID-19, la nécessité d’un rappel annuel de la vaccination contre la COVID-19 pour les populations à faible risque, comme le personnel soignant, reste incertaine. Dans cette étude, 1 745 professionnels de santé en Suisse ont été suivis pendant plusieurs mois afin d’évaluer l’impact de leur statut vaccinal sur leur risque de développer un syndrome grippal et d’être absents du travail. L’étude a révélé que les personnes ayant récemment reçu un rappel de la COVID-19 étaient plus susceptibles de signaler des symptômes et de prendre un arrêt maladie. En revanche, les personnes vaccinées contre la grippe saisonnière étaient moins susceptibles de signaler des symptômes ou de s’absenter du travail. Ces résultats suggèrent que les rappels de la COVID-19 pourraient ne pas offrir de bénéfices clairs à court terme dans un contexte post-pandémique, et pourraient même augmenter le risque de maladie à court terme. Cela soulève des questions quant à la meilleure utilisation des rappels à l’avenir.
Introduction
Le vaccin contre le SRAS-CoV-2 a largement contribué à mettre fin à la pandémie dans le monde et des doses de rappel ont été recommandées pour les populations à risque. 1 , 2 Les professionnels de santé, en première ligne face à la pandémie, étaient initialement considérés comme une population à risque en raison de leur forte exposition aux patients infectieux. Dans le contexte actuel de transition vers l’endémicité du SRAS-CoV-2, l’intérêt d’une nouvelle vaccination pour cette population est sujet à débat, car la protection contre les souches virales du SRAS-CoV-2 actuellement en circulation est incertaine et la COVID-19 est généralement une maladie bénigne touchant les personnes jeunes ou d’âge moyen en bonne santé. De plus, les effets indésirables potentiels de la vaccination doivent être pris en compte. Les réactions immédiates après la vaccination, telles que douleur au point d’injection, maux de tête ou fièvre, sont fréquentes et, bien que généralement bénignes, peuvent être d’une gravité invalidante. 3 . Des études observationnelles récentes ont également suggéré un risque plus élevé de réinfection après une vaccination de rappel 4 , 5 , 6 , 7 , 8 , 9 et bien que cela puisse être attribué à un biais de sélection 7 , 10 , une évaluation attentive des risques et des bénéfices est justifiée. D’autre part, une prévention efficace des infections pourrait préserver le personnel soignant en tant que ressource sociétale précieuse et, grâce à la prévention de la transmission, protéger également les patients.
Dans une cohorte de professionnels de santé, nous avons cherché à identifier les facteurs associés à la survenue d’épisodes de syndrome respiratoire grippal (SRG) et aux journées de travail perdues pour cause de SRG pendant une période de forte transmission communautaire du SRAS-CoV-2. Nous avons notamment cherché à identifier l’impact du statut vaccinal contre le SRAS-CoV-2 sur ces résultats. Les résultats suggèrent que, dans une population de professionnels de santé, la vaccination de rappel contre le SRAS-CoV-2 est associée à un risque temporairement accru de SRG et de journées de travail perdues, tandis que la vaccination contre la grippe est associée à un risque réduit.
Méthodes
Cadre et participants
Dans notre cohorte prospective multicentrique de professionnels de santé, les participants ont été recrutés dans neuf réseaux de soins de santé du nord et de l’est de la Suisse et suivis depuis août 2020. Tous les employés hospitaliers, en contact ou non avec les patients, âgés de 16 ans ou plus, étaient éligibles à l’inclusion et recrutés après avoir donné leur consentement éclairé. L’étude et le protocole ont été approuvés par le Comité d’éthique de la Suisse orientale (n° 2020–00502).
Collecte de données
En octobre 2023, tous les participants, nouveaux ou en cours d’inscription, ont fourni ou mis à jour leurs données de base (âge, sexe, déterminants de santé, facteurs liés à la vie professionnelle et sociale), ainsi que des informations sur leurs antécédents d’infection par le SARS-CoV-2 (nombre et date des résultats positifs) et leurs vaccinations contre le SARS-CoV-2 (nombre, date et type). Il leur a également été demandé de fournir un échantillon de sérum testé pour la recherche d’anticorps anti-spike (anti-S) et anti-nucléosides (anti-N) anti-SARS-CoV-2. Les anticorps anti-S et anti-N ont été détectés grâce au test immuno-électrochimiluminescence Roche Elecsys (Roche Diagnostics, Rotkreuz, Suisse). 11 . Dans les questionnaires de suivi hebdomadaires entre le 1er novembre St 2023 et 30 avril ème En 2024, les participants ont indiqué la présence de l’un des 22 symptômes respiratoires, gastro-intestinaux et généraux (tableau supplémentaire 1 ) avec une apparition aiguë (nouvelle apparition au cours des 7 jours précédents) au cours des 7 derniers jours, des jours d’absence du travail attribuables aux symptômes et ont documenté toute vaccination contre le SRAS-CoV-2 ou la grippe saisonnière, y compris des détails sur le type de vaccin.
Pour cette analyse, nous avons inclus uniquement les 1 745 participants (87,6 %) ayant fourni au moins 50 % des questionnaires de suivi (soit 13 ou plus). De plus, nous avons exclu les personnes ayant déclaré avoir reçu plus de quatre doses de vaccin, car ≥ 5 doses n’étaient recommandées que pour des populations hautement sélectionnées par le gouvernement suisse, ainsi que les personnes ayant reçu une vaccination contre le SRAS-CoV-2 pendant la période de suivi.
Prédicteurs et résultats
Le statut vaccinal a été utilisé comme principal prédicteur et traité comme une variable catégorielle, car nous avons supposé un effet non linéaire du nombre de vaccinations sur le résultat. Les participants ont été répartis selon qu’ils étaient non vaccinés ; qu’ils avaient reçu une ou deux doses de vaccin contre le SRAS-CoV-2 (car après la première vague de COVID-19, les personnes ayant reçu une dose de vaccin et une infection documentée étaient considérées comme complètement vaccinées), trois vaccinations (la majorité avec un premier rappel) ; ou quatre vaccinations (la majorité avec un deuxième rappel). Parmi les personnes ayant reçu quatre vaccinations, 85,2 % ont reçu le vaccin bivalent. Les définitions exactes des autres prédicteurs sont présentées dans le tableau supplémentaire 2 .
Le syndrome grippal a été choisi comme critère d’évaluation principal car il peut indiquer l’activité du SRAS-CoV-2 pendant les périodes de niveaux élevés de transmission communautaire. 12 , 13 Les tests de dépistage du SARS-CoV-2 ont été largement supprimés depuis la pandémie. Durant la période d’étude, 21,1 % des personnes testées en Suisse atteintes d’un syndrome grippal étaient positives au SARS-CoV-2 et 20,0 % à la grippe. 14 . Conformément aux Centres pour le contrôle et la prévention des maladies (CDC) 15 et le Centre européen de prévention et de contrôle des maladies (ECDC) 16 Le syndrome grippal a été défini comme l’apparition de fièvre (≥ 38,0 °C) ou une sensation de fièvre ET un symptôme respiratoire (toux, mal de gorge, rhinite ou perte d’odorat) ET un début aigu ≤ 7 jours avant la date de déclaration respective. Des analyses de sensibilité ont été réalisées en utilisant deux définitions de cas différentes, l’une étant plus clémente (début aigu de fièvre ≥ 38,0 °C ou sensation de fièvre ET tout autre symptôme demandé), l’autre étant plus restrictive (fièvre ≥ 38,0 °C ou sensation de fièvre ET ≥ 1 symptôme général parmi fatigue, maux de tête et malaise ET ≥ 2 autres symptômes). Comme critère secondaire, le nombre de journées de travail perdues en raison de ces symptômes a été examiné.
Analyses statistiques
Les caractéristiques de base et les résultats selon le statut vaccinal ont été comparés à l’aide de tests du Chi carré bilatéraux pour les variables catégorielles et d’un test de Kruskal-Wallis bilatéral pour les variables continues (en supposant une distribution non normale).
Français Pour identifier les facteurs associés au nombre de syndromes grippaux et aux journées de travail perdues, une analyse de régression uni- et multivariée a été réalisée à l’aide de modèles binomiaux négatifs avec le nombre de questionnaires de suivi répondus comme terme de décalage (analyse de cas complète). Les ratios de taux d’incidence (IRR) avec les intervalles de confiance (IC) à 95 % correspondants ont été calculés avec ajustement pour les facteurs de confusion définis a priori sélectionnés en fonction des connaissances scientifiques des facteurs de risque et des associations trouvées précédemment dans notre cohorte. Il s’agissait de l’âge, du sexe, de l’indice de masse corporelle (IMC), du statut tabagique, de la présence de toute comorbidité pertinente (c.-à-d. cancer, troubles immunosuppresseurs, maladie cardiovasculaire, maladie pulmonaire), du fait de vivre avec des enfants de moins de 12 ans, du nombre total de prélèvements positifs au SRAS-CoV-2 signalés depuis le début de la pandémie et jusqu’en octobre 2023, du contact avec les patients et de la réception du vaccin contre la grippe saisonnière pour 2023/2024 (tableau supplémentaire 2 ). En raison d’une suspicion de multicolinéarité entre le statut vaccinal et la date de la dernière vaccination, deux modèles différents (modèle 1 : sans date de la dernière vaccination ; modèle 2 : avec date de la dernière vaccination) ont été ajustés. Afin de tenir compte du statut vaccinal contre la grippe comme facteur de confusion potentiellement le plus important, une analyse de sous-groupe pour le résultat SG a été réalisée, incluant uniquement les professionnels de santé non vaccinés contre la grippe saisonnière. Pour étudier l’effet des formulations de vaccins bivalents, une analyse de sensibilité supplémentaire a été réalisée, où les participants ayant reçu 3 ou 4 vaccins ont été regroupés afin d’éviter la multicolinéarité (les personnes ayant reçu des vaccins bivalents étant principalement celles ayant reçu 4 vaccins).
Afin de tester la robustesse de nos résultats et de réduire les facteurs de confusion potentiels lors de l’étude de l’effet du vaccin contre le SRAS-CoV-2, nous avons procédé à une pondération de la probabilité inverse du traitement (IPTW). Dans un premier temps, les scores de propension ont été calculés à l’aide d’une régression généralisée (fonction mnps du package R « twang ») avec comme critère d’évaluation le nombre de vaccins administrés et comme variables indépendantes connues pour influencer le risque d’infection par le SRAS-CoV-2 : l’âge, le sexe, l’IMC, les comorbidités, les contacts avec le patient, la présence d’enfants à domicile, les prélèvements positifs antérieurs et le statut tabagique. Pour tenir compte des scores de propension extrêmes et améliorer la robustesse, nous avons utilisé la méthode de pondération par chevauchement. 17 a été utilisé pour calculer les pondérations. L’équilibre des covariables après pondération a été évalué à l’aide des différences moyennes standardisées (DMS), les DMS inférieures à 0,1 indiquant un équilibre suffisant. Dans l’analyse IPTW, les deux modèles binomiaux négatifs ont été réalisés, ce qui a permis une estimation plus précise de l’effet moyen du traitement de la réception d’un certain nombre de vaccins sur le nombre de syndromes grippaux. Nous avons utilisé le logiciel statistique R (version 4.4.0) avec les packages « tableone », « nlme », « MASS » et « twang » pour les analyses. Le niveau de signification statistique a été défini à α = 0,05.
Résumé du rapport
De plus amples informations sur la conception de la recherche sont disponibles dans le résumé du rapport Nature Portfolio lié à cet article.
Résultats
Population
Français Sur les 2113 professionnels de santé ayant rempli le questionnaire de référence en septembre 2023, 1745 (82,6 %) ont été inclus, avec un âge médian de 46 ans (entre 17 et 70 ans) et 81,6 % étaient des femmes (Fig. 1 ). Parmi eux, 175 (10,0 %) n’étaient pas vaccinés, 364 (20,9 %) avaient reçu 1 ou 2 doses de vaccin, 895 (51,3 %) en avaient déclaré 3 et 311 (17,8 %) avaient déclaré 4 doses de vaccin. Les personnes ayant reçu 3 ou 4 doses de vaccin contre le SRAS-CoV-2 avaient tendance à être plus âgées, plus susceptibles de déclarer des comorbidités et d’avoir été vaccinées contre la grippe saisonnière. Elles ont également déclaré moins d’infections antérieures par le SRAS-CoV-2 et étaient moins susceptibles de présenter des anticorps antinucléosidiques (anti-N) détectables (Tableau 1 ). Français Parmi les personnes vaccinées contre le SRAS-CoV-2, 1’534 (97,7 %) avaient reçu ≥1 vaccin basé sur la technologie de l’ARN messager (ARNm) et 319 (18,3 %) avaient reçu ≥1 rappel avec un vaccin bivalent (Fig. 1 supplémentaire ). Parmi celles ayant reçu 4 doses de vaccin, 265 (85,2 %) avaient reçu le vaccin bivalent contre 54 (4,3 %) de celles ayant reçu moins de 4 doses.
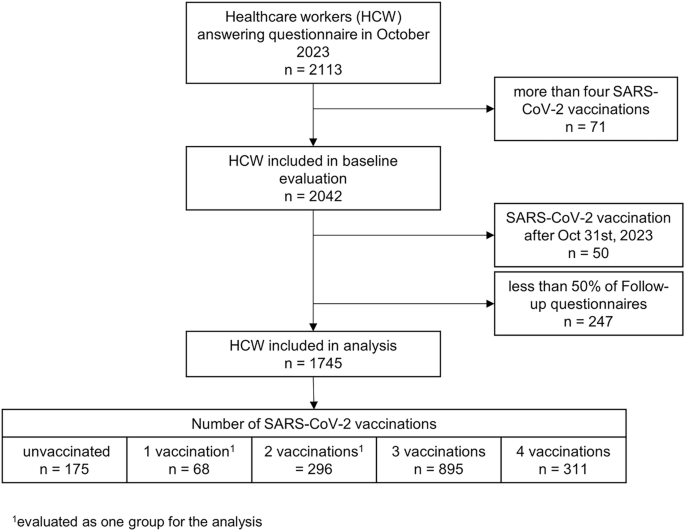
Tableau 1 Caractéristiques de base des professionnels de santé en octobre 2023 ( n et %, sauf mention contraire)
Contexte épidémiologique et analyse univariée des résultats
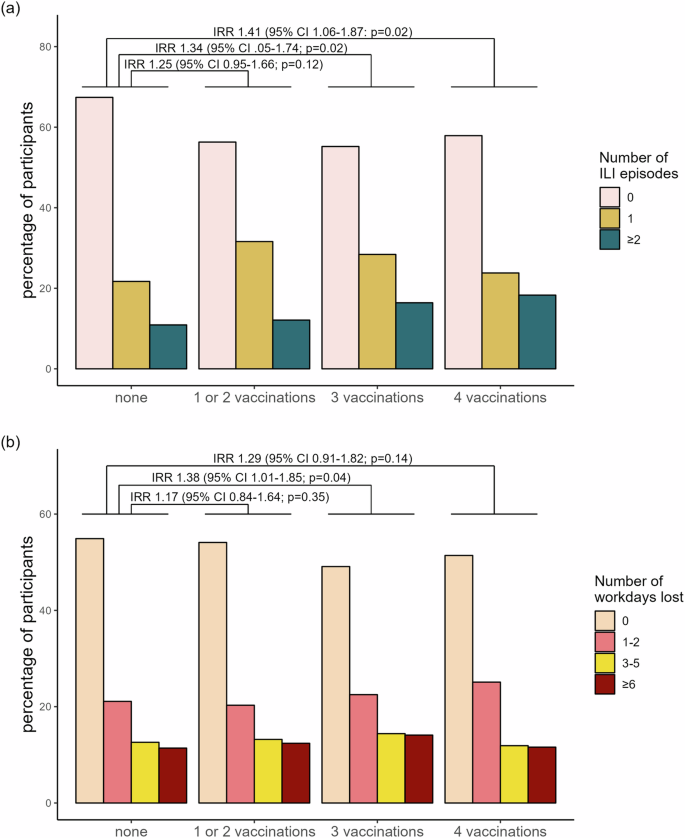
Français La distribution de fréquence des syndromes grippaux (SG) – définis selon les CDC et l’ECDC – a suivi l’épidémiologie locale du SRAS-CoV-2 et de la grippe dans la population générale (Fig. 2 supplémentaire ), avec 748 (42,9 %) professionnels de santé déclarant au moins un SG pendant le suivi et 35,7 % (267/748) ayant connu plus d’un épisode. Au total, 853 (48,9 %) ont déclaré au moins un jour d’absence en raison de symptômes de SG, la majorité (76,6 %) étant en arrêt maladie pendant plusieurs jours. Dans l’analyse univariée, le statut vaccinal avec 3 et 4 doses était significativement associé au nombre de syndromes grippaux (IRR 1,34, IC à 95 % 1,05–1,74 et 1,41, IC à 95 % 1,06–1,87 respectivement), et, pour 3 doses également aux journées de travail perdues (IRR 1,38, IC à 95 % 1,01–1,85), (Fig. 2 ; pour les chiffres bruts, voir le tableau supplémentaire 3 ).
Analyse multivariée des facteurs de risque associés au syndrome grippal
Français Dans le modèle de régression multivariable (binomiale négative) 1 (sans la variable heure de la dernière vaccination contre le SRAS-CoV-2), le risque de syndrome grippal était significativement associé au statut vaccinal pour les personnes ayant reçu 3 ou 4 vaccinations (aIRR 1,56, IC à 95 % 1,22-2,03 et 1,70, IC à 95 % 1,27-2,28, respectivement). De plus, le nombre de tests positifs au SRAS-CoV-2 et la présence de comorbidités étaient positivement associés au nombre d’épisodes de syndrome grippal, tandis que la vaccination contre la grippe saisonnière et l’âge étaient associés à une diminution du risque. Après l’inclusion du moment de la dernière vaccination (variable catégorielle basée sur les recommandations du gouvernement suisse dans le modèle 2), le risque de syndrome grippal n’était plus associé au nombre de vaccinations, mais une vaccination plus récente était significativement associée au nombre de syndromes grippaux (aIRR 1,32, IC à 95 % 1,07-1,62). Pour les autres variables, des résultats similaires à ceux du modèle 1 ont été observés (tableau 2 ). Les analyses de sensibilité, avec des définitions plus ou moins restrictives du syndrome grippal, ont montré les mêmes tendances (tableaux supplémentaires). 4 , 5 ) comme l’a fait une analyse de sensibilité évaluant l’effet des formulations de vaccins bivalents (tableau supplémentaire 6 ). La restriction de l’analyse aux personnes non vaccinées contre la grippe n’a pas non plus montré de différences (tableau supplémentaire 7 ). Tableau 2 Analyse de régression multivariée pour les facteurs associés au nombre d’épisodes de syndrome grippal comme résultat
Pondération de la probabilité inverse du traitement (IPTW)
Français Pour tester la robustesse de nos résultats, nous avons effectué une analyse de sensibilité en utilisant l’IPTW qui tient compte davantage des facteurs de confusion potentiels en équilibrant les caractéristiques des participants entre les catégories de statut vaccinal. Après application de la pondération de chevauchement, toutes les covariables incluses dans les modèles ci-dessus, à l’exception du nombre d’écouvillons positifs, ont été équilibrées avec succès (Fig. 3 supplémentaire ). Les résultats des modèles binomiaux négatifs dans la population IPTW avec un syndrome grippal comme résultat étaient similaires à ceux du modèle 2, l’heure de la dernière vaccination (aIRR 1,26, IC à 95 % 1,12-1,43) et la vaccination contre la grippe saisonnière (aIRR 0,87, IC à 95 % 0,79-0,96) étant significativement associées au résultat, contrairement au statut vaccinal (Tableau 3 ). Tableau 3 Modèle binomial négatif pour l’association de la vaccination contre le SRAS-CoV-2 avec le nombre d’épisodes de syndrome grippal après application d’une pondération de probabilité inverse
Résultat secondaire : perte de journées de travail
Français Dans l’analyse multivariée, le statut vaccinal contre le SRAS-CoV-2 a également montré une association avec le nombre cumulé de jours de travail perdus en raison d’un syndrome grippal (aIRR pour 1 ou 2 vaccinations 1,13, IC à 95 % 0,80–1,58 ; pour 3 vaccinations 1,49, IC à 95 % 1,08–2,01 ; pour 4 vaccinations 1,50, IC à 95 % 1,04–2,13), tout comme la présence de comorbidités, le nombre d’écouvillons positifs au SRAS-CoV-2 et l’IMC. La vaccination contre la grippe et le contact direct avec les patients étaient associés à un nombre réduit de jours perdus (tableau 4 ). Tableau 4 Analyse de régression multivariée des facteurs associés aux journées de travail perdues
Discussion
Dans cette étude des facteurs associés aux épisodes de syndrome grippal post-pandémique et à l’absentéisme au travail, nous avons constaté que le nombre de vaccinations contre le SRAS-CoV-2 et les infections antérieures par le SRAS-CoV-2 étaient positivement associés à ces deux résultats. En revanche, la vaccination contre la grippe saisonnière était corrélée à une diminution du risque. Concernant la vaccination contre le SRAS-CoV-2, la forte association avec une vaccination plus récente par rapport au nombre absolu de doses de vaccin suggère un effet temporel. Ce signal était cohérent dans l’analyse IPTW et les analyses de sensibilité.
Avec plus d’un tiers des professionnels de santé souffrant de syndrome grippal pendant l’hiver et une perte moyenne de deux jours de travail par employé, les infections respiratoires constituent un fardeau important dans notre cohorte. La vaccination contre le SARS-CoV-2 n’a pas été associée à un effet protecteur contre le syndrome grippal. Au contraire, nous avons observé un risque cliniquement significatif de syndrome grippal, avec une augmentation pouvant atteindre 70 %. Ces résultats concordent avec plusieurs études récemment publiées qui se sont concentrées sur le risque de réinfection par le SARS-CoV-2. 7 , 8 , 9 , 18 Ils ont rapporté des rapports de risque compris entre 1,4 et 3,6 pour les personnes vaccinées contre le SRAS-CoV-2 par rapport à celles qui n’en avaient pas reçu (ou moins de doses). 4 , 7 , 8 , 9 . Dans nos données, cette association de risque était plus forte avec une vaccination plus récente qu’avec le nombre de doses reçues, ce qui suggère que l’association est temporaire et s’atténue avec le temps.
L’association entre la vaccination de rappel contre le SRAS-CoV-2 et un risque accru de réinfection par le SRAS-CoV-2 a été émise comme hypothèse, en raison d’un biais de sélection survenant lors de l’analyse des individus ayant déjà été infectés et qui pourraient être plus sensibles en moyenne. 10 Afin de tenir compte de ces facteurs liés aux données observationnelles, l’IPTW a été réalisée, et les résultats suggèrent une relation de cause à effet entre la vaccination contre le SRAS-CoV-2 et les résultats. De plus, l’association est restée significative même après ajustement en fonction du nombre d’infections antérieures par le SRAS-CoV-2, ce qui pourrait servir de substitut à la sensibilité individuelle. De plus, l’association entre la vaccination contre la grippe saisonnière et la diminution du risque de résultats est conforme aux données largement acceptées. 19 , 20 , 21 . De plus, la taille de l’effet correspond aux preuves rassemblées 19 , 20 , 21 Ce qui confirme la validité de nos résultats. Plusieurs études en laboratoire suggèrent une empreinte immunitaire lors d’une vaccination de rappel contre le SRAS-CoV-2 ; cependant, les données sur les mécanismes biologiques explicatifs sont rares. Certaines études suggèrent que les vaccins contre le SRAS-CoV-2 pourraient avoir des effets immunologiques hétérologues et altérer la réponse immunitaire innée. 22 , 23 , 24 Il est intéressant de noter que la variabilité et l’étendue des changements métaboliques et transcriptomiques des cellules immunitaires innées face à divers stimuli se sont avérées accrues après la vaccination contre le SRAS-CoV-2 à transmission vectorielle. 22 , mais atténué après la vaccination à ARNm contre le SRAS-CoV-2 25 , qui a été reçu par la majorité de notre cohorte. De plus, des altérations du système immunitaire adaptatif ont été mises en évidence dans des modèles animaux avec des nanoparticules lipidiques hautement immunogènes issues de vaccins à ARNm contre le SARS-CoV-2. 26 , 27 , induisant l’épuisement des lymphocytes T 27 Comme pour nos résultats, une diminution de cet effet au fil du temps a été observée. De plus, la protection contre la réinfection est différemment influencée par l’immunité acquise grâce à l’infection, à la vaccination ou à une combinaison des deux. 6 , 28 L’infection naturelle, également reflétée par un taux d’anti-N plus élevé, semble être corrélée à la protection 29 , et la proportion de personnes anti-N-positives observée dans les groupes les moins vaccinés de notre cohorte pourrait ainsi contribuer à l’association observée. De plus, il a été démontré que l’application de calendriers vaccinaux hétérologues (c.-à-d. formulations vaccinales à ARNm et à vecteur) est associée à une diminution du risque de COVID-19. 30 . Cependant, des recherches supplémentaires sont nécessaires pour élucider la présence et la nature des mécanismes sous-jacents à l’association observable.
Il est intéressant de noter que les professionnels de santé impliqués dans les soins directs aux patients ont déclaré moins de jours d’arrêt maladie, malgré l’absence de différence dans le nombre de syndromes grippaux. Des études antérieures ont montré qu’une grande proportion de professionnels de santé atteints de syndromes grippaux travaillent malgré des symptômes. 31 , 32 . Pendant la pandémie, aucune différence n’a été observée entre les personnes en contact avec les patients et celles qui n’y étaient pas en contact. 33 , le comportement post-pandémique pourrait être plus comparable aux habitudes pré-pandémiques 34 lorsque le sens du devoir envers les patients a conduit de nombreux professionnels de santé à travailler malgré les symptômes 35 , 36 Cela expose non seulement les patients, mais aussi les autres professionnels de santé à un risque d’infection. 37 , 38 , 39 et pourrait contribuer à la perte moyenne de deux jours de travail par travailleur de la santé au cours d’une seule saison hivernale. Conformément aux rapports précédents 31 , 34 Ces chiffres représentent un fardeau important pour les systèmes de santé. Cela souligne la nécessité d’identifier des stratégies pour protéger les professionnels de santé contre les syndromes grippaux.
Un point fort important de notre étude réside dans la disponibilité d’informations détaillées sur les symptômes hebdomadaires, issues d’une cohorte présentant une réponse élevée et un faible taux d’attrition. De plus, le groupe relativement important de personnes non vaccinées offre des opportunités uniques et constitue un atout majeur. Le statut vaccinal est par ailleurs clairement défini pour chaque individu et, bien qu’autodéclaré, sa fiabilité a été démontrée par des validations antérieures. 11 , 40 Cependant, notre étude présente des limites. Premièrement, nous n’avons pas testé les agents pathogènes ; les étiologies virales ne peuvent donc être extrapolées qu’à partir d’une corrélation avec les données épidémiologiques locales. Bien que les professionnels de santé puissent avoir une exposition accrue aux agents pathogènes respiratoires en raison de leur profession, nous n’avons pas constaté de lien entre le contact avec les patients et le nombre de syndromes grippaux. Deuxièmement, la dernière vaccination contre le SRAS-CoV-2 remontait à plus d’un an pour la grande majorité de notre cohorte, tandis que la vaccination contre la grippe saisonnière pouvait également être administrée pendant la période de suivi. Cela pourrait fausser les résultats ; cependant, une analyse de sensibilité incluant uniquement les personnes non vaccinées contre la grippe n’a montré aucune divergence. Troisièmement, l’effet des vaccins bivalents n’a pas pu être inclus dans notre modèle principal en raison de la multicolinéarité. Cependant, selon les résultats de notre analyse de sensibilité, nous n’avons observé aucun effet supplémentaire du vaccin bivalent. Quatrièmement, nous n’avons inclus que des professionnels de santé majoritairement en bonne santé et de sexe féminin, ce qui limite la généralisabilité à d’autres populations, et la population étudiée est relativement petite. Cinquièmement, bien que l’IPTW soit une méthode reconnue et doublement robuste pour la pseudo-randomisation des études observationnelles, seuls les facteurs de confusion connus peuvent être pris en compte, laissant la possibilité d’un facteur de confusion non mesuré. Enfin, nous ne pouvons que spéculer sur les mécanismes immunologiques susceptibles d’être à l’origine de ces résultats. N’ayant obtenu aucun échantillon cellulaire des participants, nous n’avons pas pu approfondir les mécanismes qui impliquent très probablement les voies de l’immunité cellulaire. De plus, les facteurs de confusion résiduels et les limites posées par la conception de l’étude pourraient contribuer aux effets observés.
Sur la base de nos données, nous concluons que la vaccination de rappel contre le SRAS-CoV-2 n’a pas contribué à une protection mesurable des personnels de santé étudiés et pourrait même augmenter temporairement le risque d’infection symptomatique et d’absentéisme. Cependant, des recherches complémentaires confirmant nos résultats et examinant les mécanismes immunologiques supposés à l’origine de ce phénomène sont nécessaires.
Disponibilité des données
Les données de la figure 2 sont présentées dans le tableau supplémentaire 3. Les données brutes de l’étude ne sont pas encore accessibles au public, car des analyses complémentaires sont en cours. Cependant, elles sont disponibles auprès de l’auteur correspondant sur demande raisonnable.
Disponibilité des codes
Les codes statistiques sont disponibles sur le référentiel de données dryad ( https://doi.org/10.5061/dryad.v41ns1s88 ) 41 .
Références
- Organisation mondiale de la Santé. Feuille de route SAGE de l’OMS pour la priorisation des utilisations des vaccins contre la COVID-19. https://www.who.int/publications/i/item/WHO-2019-nCoV-Vaccines-SAGE-Prioritization-2023.1 (2023).
- Office fédéral de la santé publique (OFSP). Directives et recommandations pour la vaccination contre la Covid-19 [allemand]. https://backend.bag.admin.ch/fileservice/sdweb-docs-prod-bagadminch-files/files/2025/03/18/7109ca20-df42-4a90-a84b-9d356f217877.pdf (2023).
- Patel, R., Kaki, M., Potluri, VS, Kahar, P. & Khanna, D. Une revue complète des vaccins contre le SRAS-CoV-2 : Pfizer, Moderna et Johnson & Johnson. Hum. Vaccin Immunother. 18 , 2002083 (2022). PubMed PubMed Central Google Scholar
- Reynolds, CJ et al. Le renforcement immunitaire par B.1.1.529 (Omicron) dépend de l’exposition antérieure au SARS-CoV-2. Science 377 , eabq1841 (2022). CAS PubMed Google Scholar
- Roltgen, K. et al. Empreinte immunitaire, étendue de la reconnaissance des variants et réponse du centre germinatif dans l’infection et la vaccination humaines par le SARS-CoV-2. Cellule 185 , 1025–1040.e1014 (2022). CAS PubMed PubMed Central Google Scholar
- Hoffmann, M. et al. Effet de l’immunité hybride et de la vaccination de rappel bivalente sur la neutralisation de la sous-lignée omicron. Lancet Infect. Dis. 23 , 25–28 (2023). PubMed Google Scholar
- Chalupka, A. et al. Efficacité d’une quatrième dose de vaccin contre le SRAS-CoV-2 chez des personnes précédemment infectées en Autriche. Eur. J. Clin. Invest 54 , e14136 (2024). CAS PubMed Google Scholar
- Chemaitelly, H. et al. Historique de la vaccination primaire et de rappel et protection contre la réinfection par Omicron. Sci. Adv. 9 , eadh0761 (2023). PubMed PubMed Central Google Scholar
- Eythorsson, E., Runolfsdottir, HL, Ingvarsson, RF, Sigurdsson, MI & Palsson, R. Taux de réinfection par le SARS-CoV-2 lors d’une vague Omicron en Islande. JAMA Netw. Open 5 , e2225320 (2022). PubMed PubMed Central Google Scholar
- Monge, S., Pastor-Barriuso, R. & Hernan, MA L’effet d’empreinte des vaccins contre la covid-19 : un biais de sélection attendu dans les études observationnelles. BMJ 381 , e074404 (2023). PubMed Google Scholar
- Kahlert, CR et al. Facteurs non professionnels et professionnels associés à des anticorps spécifiques contre le SRAS-CoV-2 chez les travailleurs hospitaliers – Une étude transversale multicentrique. Clin. Microbiol. Infect. 27 , 1336–1344 (2021). CAS PubMed PubMed Central Google Scholar
- Cobb, NL et al. Systèmes mondiaux de surveillance de la grippe pour détecter la propagation de maladies pseudo-grippales négatives à la grippe pendant la pandémie de COVID-19 : analyses des valeurs aberrantes des séries chronologiques de 2015 à 2020. PLoS Med. 19 , e1004035 (2022). CAS PubMed PubMed Central Google Scholar
- Dietz, E. et al. Positivité du SARS-CoV-2, de la grippe A/B et du virus respiratoire syncytial et association avec un syndrome grippal et des symptômes autodéclarés, au cours de la saison hivernale 2022/23 au Royaume-Uni : une cohorte de surveillance longitudinale. BMC Med. 22 , 143 (2024). CAS PubMed PubMed Central Google Scholar
- Office fédéral de la santé publique (OFSP). Tableau de bord des maladies infectieuses : Grippe saisonnière. https://www.idd.bag.admin.ch/diseases/influenza/overview (2024).
- Centres pour le contrôle et la prévention des maladies (CDC). Surveillance de la grippe aux États-Unis : objectif et méthodes. https://www.cdc.gov/fluview/overview/?CDC_AAref_Val=https://www.cdc.gov/flu/weekly/overview.htm (2025).
- Centre européen de prévention et de contrôle des maladies (ECDC). Décision d’exécution (UE) 2018/945 de la Commission du 22 juin 2018 relative aux maladies transmissibles et aux problèmes sanitaires particuliers connexes devant faire l’objet d’une surveillance épidémiologique, ainsi qu’aux définitions de cas pertinentes (Journal officiel de l’Union européenne, 2018). https://eur-lex.europa.eu/legal-content/FR/TXT/PDF/?uri=CELEX:32018D0945&from=FR#page=24 .
- Li, F., Thomas, LE & Li, F. Aborder les scores de propension extrême via les pondérations de chevauchement. Am. J. Epidemiol. 188 , 250–257 (2019). PubMed Google Scholar
- Shrestha, NK et al. Vaccination de rappel contre la maladie à coronavirus 2019 chez les personnes précédemment infectées ou vaccinées. Clin. Infect. Dis. 75 , 2169–2177 (2022). PubMed Google Scholar
- Thomas, RE, Jefferson, T. & Lasserson, TJ Vaccination contre la grippe pour les professionnels de santé qui travaillent avec les personnes âgées. Cochrane Database Syst. Rev. , CD005187 (2010). https://doi.org/10.1002/14651858.CD005187.pub3 .
- Li, T. et al. Une revue systématique et une méta-analyse de la vaccination contre la grippe saisonnière des agents de santé. Vaccins 9 , 1104 (2021). PubMed PubMed Central Google Scholar
- Imai, C. et al. Une revue systématique et une méta-analyse des effets épidémiologiques et économiques directs de la vaccination contre la grippe saisonnière sur les professionnels de santé. PLoS One 13 , e0198685 (2018). PubMed PubMed Central Google Scholar
- Murphy, DM et al. Une immunité entraînée est induite chez l’homme après immunisation avec un vaccin à vecteur adénoviral contre la COVID-19. J. Clin. Invest. 133 , e162581 (2023). CAS PubMed PubMed Central Google Scholar
- Noe, A. et al. La vaccination BNT162b2 contre la COVID-19 chez les enfants modifie les réponses des cytokines aux agents pathogènes hétérologues et aux agonistes des récepteurs de type Toll. Front. Immunol. 14 , 1242380 (2023). CAS PubMed PubMed Central Google Scholar
- Arunachalam, PS et al. Vaccinologie systémique du vaccin à ARNm BNT162b2 chez l’homme. Nature 596 , 410–416 (2021). CAS PubMed PubMed Central Google Scholar
- Fohse, K. et al. L’impact du vaccin à ARNm BNT162b2 sur les réponses immunitaires adaptatives et innées. Clin. Immunol. 255 , 109762 (2023). CAS PubMed Google Scholar
- Li, C. et al. Mécanismes de l’immunité innée et adaptative au vaccin Pfizer-BioNTech BNT162b2. Nat. Immunol. 23 , 543–555 (2022). CAS PubMed PubMed Central Google Scholar
- Qin, Z., Bouteau, A., Herbst, C. & Igyarto, BZ La pré-exposition à l’ARNm-LNP inhibe les réponses immunitaires adaptatives et modifie la forme immunitaire innée de manière héréditaire. PLoS Pathog. 18 , e1010830 (2022). CAS PubMed PubMed Central Google Scholar
- Babouee Flury, B. et al. Risque et symptômes de la COVID-19 chez les professionnels de santé en fonction du statut immunitaire de base et de la vaccination de rappel pendant les vagues Delta et Omicron en Suisse – Une étude de cohorte multicentrique. PLoS Med. 19 , e1004125 (2022). CAS PubMed PubMed Central Google Scholar
- Dowell, AC et al. Anticorps spécifiques de la nucléocapside comme corrélat de protection contre la réinfection par le SARS-CoV-2 chez les enfants. J. Infect. 87 , 267–269 (2023). CAS PubMed Google Scholar
- Andersson, NW et al. Efficacité comparative des schémas vaccinaux hétérologues à troisième dose contre la COVID-19 sévère pendant la prédominance d’omicron dans les pays nordiques : analyses de cohorte basées sur la population. BMJ 382 , e074325 (2023). PubMed Google Scholar
- Blanchet Zumofen, MH, Frimpter, J. & Hansen, SA Impact de la grippe et des syndromes grippaux sur les résultats de productivité au travail : une revue systématique de la littérature. Pharmacoeconomics 41 , 253–273 (2023). PubMed Google Scholar
- Kuster, SP et al. Absentéisme et présentéisme chez les professionnels de santé en raison de maladies respiratoires. Infect. Control Hosp. Epidemiol. 42 , 268–273 (2021). PubMed Google Scholar
- Linsenmeyer, K. et al. Présentéisme pour maladie chez les professionnels de la santé pendant la pandémie de maladie à coronavirus 2019 (COVID-19) : une étude de cohorte observationnelle. Infect. Control Hosp. Epidemiol. 44 , 1693–1696 (2023). PubMed PubMed Central Google Scholar
- Chiu, S. et al. Travailler avec un syndrome grippal : présentéisme parmi le personnel de santé américain pendant la saison grippale 2014-2015. Am. J. Infect. Control 45 , 1254–1258 (2017). PubMed PubMed Central Google Scholar
- Peter, KA et al. Étendue et facteurs prédictifs du présentéisme chez les professionnels de santé travaillant dans les hôpitaux, les maisons de retraite et les organismes de soins à domicile suisses. Sci. Rep. 13 , 12042 (2023). CAS PubMed PubMed Central Google Scholar
- Hoang Johnson, D. et al. Obstacles et facteurs favorisant l’absentéisme dû à un syndrome grippal chez les professionnels de santé dans un système de soins de santé tertiaires, saison grippale 2017-2018. Infect. Control Hosp. Epidemiol. 42 , 1198–1205 (2021). PubMed Google Scholar
- Huttunen, R. & Syrjanen, J. Les professionnels de santé comme vecteurs de maladies infectieuses. Eur. J. Clin. Microbiol. Infect. Dis. 33 , 1477–1488 (2014). CAS PubMed Google Scholar
- Vanhems, P. et al. Risque de syndrome grippal dans un contexte de soins de santé aigus lors des épidémies de grippe communautaire en 2004-2005, 2005-2006 et 2006-2007 : une étude prospective. Arch. Intern Med. 171 , 151–157 (2011). PubMed Google Scholar
- Yassi, A., McGill, M., Holton, D. et Nicolle, L. Morbidité, coût et rôle de la transmission par les professionnels de la santé lors d’une éclosion de grippe dans un hôpital de soins tertiaires. Can. J. Infect. Dis. 4 , 52–56 (1993). CAS PubMed PubMed Central Google Scholar
- Kohler, P. et al. Impact du statut d’anticorps anti-SARS-CoV-2 de base sur la surveillance syndromique et le risque de COVID-19 ultérieur – une étude de cohorte multicentrique prospective. BMC Med 19 , 270 (2021). CAS PubMed PubMed Central Google Scholar
- Code statistique pour modèles multivariables. Dépôt de données numériques Dryad. https://doi.org/10.5061/dryad.v41ns1s88 .
Remerciements
Ce travail a été soutenu par le Fonds national suisse de la recherche scientifique (numéro de subvention 31CA30_196544 ; numéro de subvention PZ00P3_179919 à Philipp Kohler) et l’Académie suisse des sciences médicales (numéro de subvention YTCR 12/22 à Tamara Dörr).
Informations sur l’auteur
Notes de l’auteur
- Ces auteurs ont contribué de manière égale : Tamara Dörr, Joanne Lacy.
Auteurs et affiliations
- HOCH, Hôpital cantonal de Saint-Gall, Service des maladies infectieuses, de la prévention des infections et de la médecine des voyages, Saint-Gall, Suisse Tamara Dörr, Fabian Grässli, Matthias Schlegel, Christian R. Kahlert, Stefan P. Kuster, Philipp Kohler & Simone Kessler
- Institut d’épidémiologie, de biostatistique et de prévention (EBPI), Université de Zurich, Zurich, Suisse Joanne Lacy, Tala Ballouz, Sarah Haile, Milo A. Puhan et Philipp Kohler
- Hôpital cantonal des Grisons, Coire, Suisse Alexia Cousins
- Clinique gériatrique de Saint-Gall, Saint-Gall, Suisse Emina Kocan
- Centre de réadaptation neurologique de Zihlschlacht, Zihlschlacht, Suisse J. Carsten Möller
- Clinique Hirslanden Stephanshorn, Saint-Gall, Suisse Matthias von Kietzell
- Groupe hospitalier Fuerstenland Toggenburg, Wil, Suisse Markus Rütti
- Clinique Hirslanden de Zurich, Zurich, Suisse Reto Stocker, Joelle Keller, Maja F. Müller & Philip Rieder
- Groupe hospitalier de Thurgovie, Service des maladies infectieuses et d’épidémiologie hospitalière, Münsterlingen, Suisse Danielle Vuichard Gysin
- Département de recherche et développement, Centre national suisse de prévention des infections (Swissnoso), Berne, Suisse Danielle Vuichard Gysin
- Département des maladies infectieuses et d’épidémiologie hospitalière, Hôpital pédiatrique de Suisse orientale, Saint-Gall, Suisse Christian R. Kahlert
- Services de psychiatrie du canton de Saint-Gall, Saint-Gall, Suisse Stephan Goppel
- Centre de médecine de laboratoire Dr Risch Suisse orientale SA, Buchs, Suisse Lorenz Risch
- Université privée de la Principauté du Liechtenstein, Triesen, Liechtenstein Lorenz Risch
- Centre de médecine de laboratoire, Institut de chimie clinique, Université de Berne, Hôpital de l’Île, Berne, Suisse Lorenz Risch
Consortiums
pour le groupe d’étude SURPRISE+
- Alexia Cousins
- , Tamara Door
- , Stephan Goppel
- , Fabian Grässli
- , Christian R. Kahlert
- , Joëlle Keller
- , Simone Kessler
- , Philipp Kohler
- , Stefan P. Kuster
- , J. Carsten Möller
- , Maja F. Müller
- , Philippe Rieder
- , Lorenz Risch
- , Markus Rütti
- , Matthias Schlegel
- , Reto Stocker
- , Matthias von Kietzell
- & Danielle Vuichard Gysin
Contributions
Français PK, CRK, MS et SPK ont été impliqués dans l’acquisition du financement et la gestion de la cohorte ; PK, CRK, SPK et TD ont développé le concept de l’étude ; FG était responsable de la gestion des données ; PK, MAP, JL, SH, TB et TD ont été impliqués dans la planification de l’analyse statistique qui a été menée par JL et TD ; AC, EK, JCM, MvK, MR, RS, DV-G., CRK et PK étaient responsables de la collecte des données et des demandes de renseignements des participants dans leurs institutions respectives ; TD, JL et PK ont rédigé le manuscrit principal. TD, JL, TB, AC, FG, SH, EK, JCM, MAP, MS, MvK, MR, RS, DV-G., CRK, SPK et PK ont donné un examen critique et édité le manuscrit.
Auteur correspondant
Déclarations éthiques
Intérêts concurrents
Les auteurs ne déclarent aucun conflit d’intérêts.
Éthique
L’étude a été approuvée par le Comité d’éthique de la Suisse orientale (#2020–00502).
Évaluation par les pairs
Informations sur l’évaluation par les pairs
: Communications Medicine remercie Ya-Jankey Jagne et Eero Poukka pour leur contribution à l’évaluation par les pairs de ce travail. [Un fichier d’évaluation par les pairs est disponible].
